题目内容
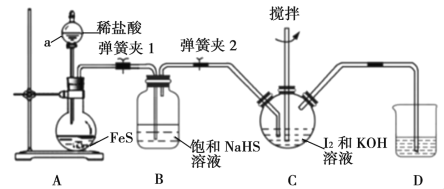
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用如图装置制备四氯化钛(部分夹持仪器已略去)。
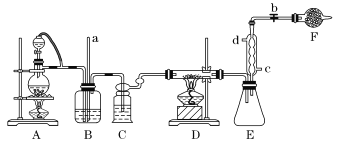
资料表明:室温下,四氯化钛为无色液体,熔点:-25℃,沸点:136.4℃。在空气中发烟生成二氧化钛固体。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)装置A中加热前应向烧瓶中加入___。
(2)实验中B装置的作用是___。
(3)写出D装置中物质制备的化学方程式___;写出四氯化钛在空气中发烟的化学方程式__。
(4)E处球形冷凝管的冷却水应从___(填“c”或“d”)口通入。
(5)F装置中盛装的物质是___。
(6)该实验设计略有缺陷,请指出其不足之处:___。
【答案】沸石或碎瓷片 洗去Cl2中的HCl气体;用作安全瓶(或用作平衡气压的安全装置,或用作防堵塞的安全装置) TiO2+2Cl2+2C![]() TiCl4+2CO TiCl4+2H2O=TiO2+4HCl↑ c 碱石灰 没有对CO进行尾气处理
TiCl4+2CO TiCl4+2H2O=TiO2+4HCl↑ c 碱石灰 没有对CO进行尾气处理
【解析】
在A装置中制备氯气,实验室用二氧化锰跟浓盐酸反应制取氯气,通过装有饱和食盐水的B瓶和装有浓硫酸的C瓶后得到干燥纯净的氯气,氯气通过装置D中二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体,按照原子守恒与气体性质,该气体为CO,E装置连接球形冷凝管冷凝,从c口入水,d口出水。F是球形干燥管,因为生成的气体为酸性氧化物,所以要装入碱性物质如碱石灰等。根据分析进行题目解答。
(1)圆底烧瓶中加入碎瓷片或沸石防止爆沸。
(2)浓盐酸易挥发,B瓶中装有饱和食盐水用于洗去Cl2中的HCl气体。且中间加入导管a用于和大气相通,平衡装置的气压,防止发生安全事故。
(3)装置D中氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO,反应方程式为TiO2+2Cl2+2C![]() TiCl4+2CO,生成的四氯化钛容易与空气中的水发生反应导致发烟现象,反应方程式为:TiCl4+2H2O=TiO2+4HCl↑。
TiCl4+2CO,生成的四氯化钛容易与空气中的水发生反应导致发烟现象,反应方程式为:TiCl4+2H2O=TiO2+4HCl↑。
(4)E装置为球形冷凝管,下口入水上口出水,所以冷却水从c口通入。
(5)F是球形干燥管,反应生成的气体为酸性气体,所以要装入如碱石灰等碱性干燥剂。
(6)CO不会被碱石灰等物质吸收,会通过F装置排出到空气中,但是CO是有毒气体,需要尾气处理装置。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。