题目内容
17.某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题.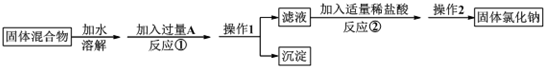
(1)A物质的化学式为Na2CO3;操作1的名称是过滤.
(2)反应①中加入略过量的A物质的目的是保证钙离子沉淀完全;判断A已过量的实验操作方法是静置后取少量上层清液,滴加适量的稀盐酸,若有气体上层,则说明碳酸钠已过量.
(3)写出反应②的化学方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O.如果加入盐酸过量,则对所得到的氯化钠的纯度没有(填“有”或“没有”)影响.
(4)分离后所得固体氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果是增大(填“增大”、“不变”或“减少”).
分析 由分离流程可知,溶解后加过量的Na2CO3可除去氯化钙,操作①为过滤,得到沉淀为碳酸钙,滤液中含NaCl、Na2CO3,加适量盐酸,与碳酸钠反应,操作②为蒸发,最后得到NaCl,以此来解答.
解答 解:由分离流程可知,溶解后加过量的Na2CO3可除去氯化钙,操作①为过滤,得到沉淀为碳酸钙,滤液中含NaCl、Na2CO3,加适量盐酸,与碳酸钠反应,操作②为蒸发,最后得到NaCl,
(1)由上述分析可知,A为Na2CO3,操作1的名称是过滤,故答案为:Na2CO3;过滤;
(2)反应①中加入略过量的A物质的目的是保证钙离子沉淀完全;判断A已过量的实验操作方法是静置后取少量上层清液,滴加适量的稀盐酸,若有气体上层,则说明碳酸钠已过量,故答案为:保证钙离子沉淀完全;静置后取少量上层清液,滴加适量的稀盐酸,若有气体上层,则说明碳酸钠已过量;
(3)反应②的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.因盐酸易挥发,如果加入盐酸过量,则对所得到的氯化钠的纯度没有影响,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(4)由反应②可知,生成NaCl,则分离后所得固体氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果是增大,故答案为:增大.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中的反应混合物分离提纯方法的选择为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 明矾是常用的净水剂、具有杀菌、消毒的作用 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 考古时,利用14C测定一些文物的年代 | |
| D. | 煤的干馏和石油的分馏都是化学变化 |
12.下列化学用语表示正确的是( )
| A. | 溶液中HSO3-的水解离子方程式:HSO3-+H2O?SO32-+H3O+ | |
| B. | Fe(OH)3的溶解平衡方程式:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq) | |
| C. | 溶液中SO32-的水解离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | CaCO3在水中的电离方程式:CaCO3?Ca2++CO32- |
2.工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.其反应为:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.一定温度时,向容积为2L的恒容密闭容器中充入一定量的SO2和O2,一段时间后达到平衡,反应过程中测定的部分数据见表
(1)保持温度不变,向平衡后的容器中再充入1mol SO2和0.5mol O2,再次答平衡后,0.2mol/L<c(O2)<0.3mol/L
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
9.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 | |
| B. | 1 mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 标准状况下,22.4LN2和O2混合物所含的分子数为NA |
6.某空瓶质量为20克.在相同状况下,装满氧气称其质量为21克,若装满A气体,称其质量为22克,则A的相对分子质量是( )
| A. | 16 | B. | 32 | C. | 64 | D. | 128 |
7.W、X、Y、Z均为短周期主族元素.Y的原子序数是W和Z的原子序数之和的一半,且其原子的最外层电子数与核外电子总数之比为2:7,W和Z形成的可溶性化合物WZ溶于水不能促进水的电离,W、X、Z三种元素形成的某种常见化合物M能消毒,下列说法正确的是( )
| A. | Y与Z形成的化合物中含 有离子键 | |
| B. | W、X、Z的简单离子中半径最大的是W | |
| C. | M的水溶液呈碱性 | |
| D. | 1molW单质与足量X单质反应,转移电子物质的量可能是2mol,也可能是1mol |