题目内容
【题目】氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g)![]() 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
(2)恒容密闭容器中进行合成氨反应N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,
2NH3(g) △H4 = - 92. 4 kJ·mol-1,
ΔS=-198.2Jmol-1K-1。其化学平衡常数(K)与温度的关系如下表:
温度/K | 398 | 498 | … |
平衡常数(K) | K1 | K2 | … |
K1 K2(填“>”或“<”),请分析,298K时,合成氨反应能否自发进行 。
(3) 向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。
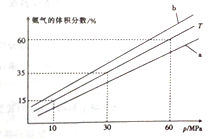
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
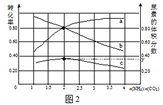
(5)氨碳比[n(NH3)/n(CO2)]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
【答案】
(1)-905.0kJ·mol-1
(2)>;能自发进行。
(3)AB;50%
(4)77.8%
(5)2;40
【解析】
试题分析:(1)已知:①2NO(g)+3H2(g)![]() 2NH3(g)+O2(g)△H1=-272.9 kJ·mol-1,②2H2(g)+O2(g)═2H2O(g)△H2= -483.6kJ·mol-1,根据盖斯定律,将②×3-①×2,得4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3=(-483.6kJ·mol-1)×3-(-272.9 kJ·mol-1)×2=-905.0kJ·mol-1,故答案为:-905.0kJ·mol-1
2NH3(g)+O2(g)△H1=-272.9 kJ·mol-1,②2H2(g)+O2(g)═2H2O(g)△H2= -483.6kJ·mol-1,根据盖斯定律,将②×3-①×2,得4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3=(-483.6kJ·mol-1)×3-(-272.9 kJ·mol-1)×2=-905.0kJ·mol-1,故答案为:-905.0kJ·mol-1
(2) N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,因此K1>K2,298K时,△G=△H-T△S=(- 92. 4 kJ·mol-1)-298K×(-198.2Jmol-1K-1)=-33.3 kJ·mol-1<0,能自发进行,故答案为:>;能自发进行。
2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,因此K1>K2,298K时,△G=△H-T△S=(- 92. 4 kJ·mol-1)-298K×(-198.2Jmol-1K-1)=-33.3 kJ·mol-1<0,能自发进行,故答案为:>;能自发进行。
(3)A.N2(g) +3H2(g) ![]() 2NH3(g),增大体系压强(p),平衡正向移动,有利于增大氨气在混合气体中的体积分数,正确;B.N2(g) +3H2(g)
2NH3(g),增大体系压强(p),平衡正向移动,有利于增大氨气在混合气体中的体积分数,正确;B.N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,降低温度,平衡正向移动,氨气在混合气体中的体积分数增大,若图中T=500℃,则温度为450℃时对应的曲线是b,正确;C.工业上采用500℃温度是因为催化剂的活性在该温度下较强,和加快反应速率,但不利于提高氮气的转化率,错误;D.当2v正(H2)=3v逆(NH3)时,反应达到平衡状态,错误;故选AB;设生成氨气的物质的量为x,则反应的氮气的物质的量为
2NH3(g) △H4 = - 92. 4 kJ·mol-1,反应为放热反应,降低温度,平衡正向移动,氨气在混合气体中的体积分数增大,若图中T=500℃,则温度为450℃时对应的曲线是b,正确;C.工业上采用500℃温度是因为催化剂的活性在该温度下较强,和加快反应速率,但不利于提高氮气的转化率,错误;D.当2v正(H2)=3v逆(NH3)时,反应达到平衡状态,错误;故选AB;设生成氨气的物质的量为x,则反应的氮气的物质的量为![]() ,则
,则![]() =25%,x=10mol,N2的转化率为
=25%,x=10mol,N2的转化率为![]() ×100%=50%,故答案为:AB;50%
×100%=50%,故答案为:AB;50%
(4)由4NH3 + 5O2 ![]() 4NO + 6H2O 、4NO + 3O2 + 2H2O = 4HNO3可得:NH3 + 2O2 = HNO3 + H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3、molH2O,则硝酸的质量分数为:
4NO + 6H2O 、4NO + 3O2 + 2H2O = 4HNO3可得:NH3 + 2O2 = HNO3 + H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3、molH2O,则硝酸的质量分数为:![]() ×100%=77.8%,故答案为:77.8%;
×100%=77.8%,故答案为:77.8%;
(5)由图可知,横坐标为n(NH3)/n(CO2)=2时,尿素的体积分数最大,且y点氨气的转化率为80%,
2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)
CO(NH2)2(g)+H2O(g)
起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.8 0.4 0.4 0.4
平衡浓度(mol/L) 0.2 0.1 0.4 0.4
平衡常数K=![]() =40,故答案为:2;40。
=40,故答案为:2;40。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案