题目内容
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() C2H4 (g)+4H2O(g) △H= a kJ/mol
C2H4 (g)+4H2O(g) △H= a kJ/mol
(1)已知:①H2和C2H4的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O(g)= H2O(l) △H= - 44 kJ/mol
则a= kJ/mol。
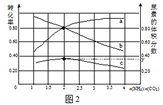
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是 ____________(填序号)。
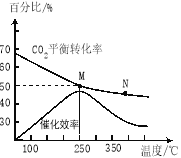
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高 CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为 3∶1的H2和CO2,则图中M点时,产物C2H4的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
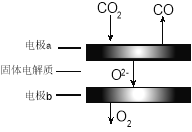
(4)利用高温电解技术可将CO2转化为高热值的燃料CO气体。
① 电极a发生的反应类型是 (填“氧化”或“还原”)反应。
② 高温电解的总反应的化学方程式为_______。
【答案】(1)-127.8
(2)①②④
(3)7.7% (或者1/13);增大压强(合理答案即给分)
(4)还原;2CO2 ![]() 2CO+O2
2CO+O2
【解析】
试题分析:(1)已知:H2(g)的燃烧热为285.8kJmol-1,则其热化学方程式为:H2(g)+0.5O2(g)=H2O(l) △H=-285.8kJ/mol①;CH2=CH2(g)的燃烧热为1411.0kJmol-1,其热化学方程式为:C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) △H=-1411.0kJ/mol②;H2O(g)=H2O(l) △H=-44.0kJmol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)![]() CH2═CH2(g)+4H2O(g) △H=-127.8kJmol-1。
CH2═CH2(g)+4H2O(g) △H=-127.8kJmol-1。
故答案为:-127.8;
(2)①化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故①错误;②温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故②错误;③升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故③正确;④为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故④错误。
故答案为:①②④;
(3)若在密闭容器中充入体积比为 3:1的 H2 和CO2,设为3mol,1mol,则图中M点时二氧化碳转化率50%,
6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.5 0.5 0.25 1
平衡量(mol) 1.5 0.5 0.25 1
产物CH2=CH2的体积分数=![]() ×100%=7.7%;
×100%=7.7%;
反应前后气体体积减小,若要进一步提高乙烯的体积分数,可采取的措施有增大压强平衡正向进行;
故答案为:7.7%,增大压强;
(4)①CO2+H2O![]() CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,与电源负极相连的电极a为阴极,与电源正极相连的电极b为阳极,a电极上是二氧化碳得到电子发生还原反应生成。
CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,与电源负极相连的电极a为阴极,与电源正极相连的电极b为阳极,a电极上是二氧化碳得到电子发生还原反应生成。
故答案为:还原;
②将CO2转化为高热值的燃料CO,依据原子守恒分析反应生成一氧化碳和氧气,反应的化学方程式为:2CO2![]() 2CO+O2。
2CO+O2。
故答案为:2CO2![]() 2CO+O2。
2CO+O2。

 高中必刷题系列答案
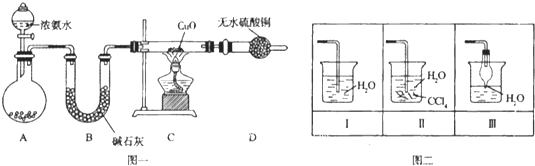
高中必刷题系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
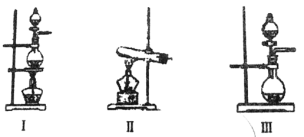
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?