题目内容
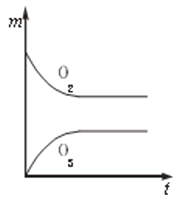
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
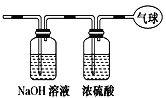
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
【答案】C
【解析】
根据混合气体的质量和在标准状况下的体积,列方程组解出其中所含CO和CO2物质的量,结合物质的性质和相关公式分析作答。
14.4 g CO和CO2的混合气体在标准状况下所占的体积约为8.96 L,则28g/moln(CO)+44g/moln(CO2)=14.4g,n(CO)+n(CO2)=![]() =0.4mol,解得n(CO)=0.2mol,n(CO2)=0.2mol;
=0.4mol,解得n(CO)=0.2mol,n(CO2)=0.2mol;
A.原混合气体所含氧原子物质的量为0.2mol+0.2mol×2=0.6mol,所含O原子数为0.6NA,A正确;
B.NaOH溶液将CO2吸收,浓硫酸干燥CO,最终气球中收集到0.2molCO,在标准状况下的体积为0.2mol×22.4L/mol=4.48L,B正确;
C.原混合气体总物质的量为0.4mol,混合气体的平均摩尔质量为![]() =36g/mol,C错误;
=36g/mol,C错误;
D.原混合气体中CO与CO2的体积之比,等于CO与CO2物质的量之比,为1:1,D正确;
答案选C。

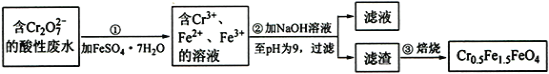
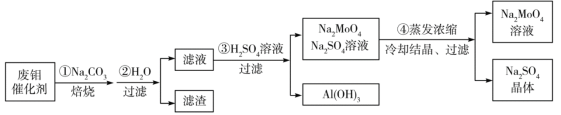
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
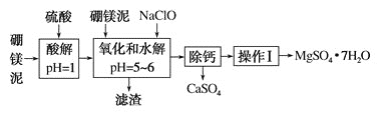
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
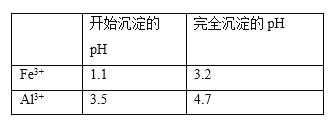
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。