题目内容
9.原子序数逐渐增大的元素A、B、C、D、E、F的有关信息如下:| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |
(1)元素F在周期表中的位置是第四周期IB族,E形成的低价离子的电子排布式为1s22s22p63s23p63d10.
(2)A、C的氢化物沸点较高的是(用所形成的氢化物表示)H2O,A、B、C的第一电离能大小顺序是(用元素符号表示)N>O>C.
(3)A与氢元素形成的A2H2含有的σ键、π键数目之比为3:2.
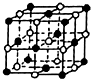
(4)KCl的晶胞如图:“●K,○Cl”,则该晶胞中含K+为4个,已知晶胞参数为:629.8pm(1pm=10-12m),求KCl晶体的密度为$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3(只写出表达式,不要求计算结果).
(5)用惰性电极电解FCl2溶液时,在阴极除了析出红色固体外,还析出白色固体,经检验白色固体为FCl,请写出析出白色固体的阴极反应式Cu2++Cl-+e-=CuCl.
分析 原子序数逐渐增大的元素A、B、C、D、E、F,A元素原子最外层电子数为内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;C元素形成的一种单质可抵御紫外线对地球生物的伤害,则C为O元素;B的原子序数介于碳、氧之间,故B为N元素;D是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色,则D为Cl;E的单质是生活中使用最广泛的金属,则E为Fe;F形成的一种化合物可用于醛基的检验,则F为Cu,据此解答.
解答 解:原子序数逐渐增大的元素A、B、C、D、E、F,A元素原子最外层电子数为内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;C元素形成的一种单质可抵御紫外线对地球生物的伤害,则C为O元素;B的原子序数介于碳、氧之间,故B为N元素;D是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色,则D为Cl;E的单质是生活中使用最广泛的金属,则E为Fe;F形成的一种化合物可用于醛基的检验,则F为Cu.
(1)元素F为Cu,在周期表中的位置是:第四周期IB族,Fe形成的低价离子的电子排布式为:1s22s22p63s23p63d10,故答案为:第四周期IB族;1s22s22p63s23p63d10;
(2)A、C的氢化物分别为CH4、H2O,二者均为分子晶体,且水分子之间存在氢键,沸点高于甲烷;同周期随原子序数增大元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
故答案为:H2O;N>O>C;
(3)A与氢元素形成的C2H2结构式为H-C≡C-H,含有的σ键、π键数目之比为3:2,故答案为:3:2;
(4)KCl的晶胞如图,则该晶胞中含K+数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶胞的质量为4×$\frac{(39+35.5)}{6.02×1{0}^{23}}$g,晶胞棱长为629.8pm(1pm=10-12m),则KCl晶体的密度为=4×$\frac{(39+35.5)}{6.02×1{0}^{23}}$g÷(629.8×10-10cm)3=$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3,
故答案为:4;$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$;
(5)用惰性电极电解CuCl2溶液时,阴极发生还原反应生成Cu与CuCl,析出CuCl的电极反应式为:Cu2++Cl-+e-=CuCl,
故答案为:Cu2++Cl-+e-=CuCl.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、熔沸点比较、化学键、晶胞计算、电解等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
| A. | 向某溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,则该溶液中一定含有SO42- | |
| B. | 用饱和NaHCO3溶液除去CO2气体中混有的少量SO2 | |
| C. | 将产生的气体依次通过足量的溴水和澄清石灰水,检验浓H2SO4与木炭反应生成的气体产物 | |
| D. | 实验室制取氢气,为了加快反应速率,可向稀硫酸中滴加少量Cu(NO3)2 |
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
| A. | 化学反应限度可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到反应限度(化学平衡)时,正、逆反应速率相等 | |
| D. | 可以通过改变外界条件控制化学反应的限度 |
| A. | 铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 | |
| B. | 久置的浓硝酸呈黄色 | |
| C. | 硝酸电离出的H+能被Zn、Fe等金属还原成H2 | |
| D. | 浓硫酸是一种干燥剂,能够干燥Cl2、氧气等气体 |
 .
.