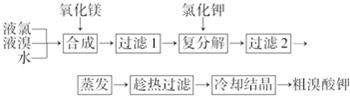
题目内容
14.不能用离子方程式Ba2++SO42-═BaSO4↓表示的化学反应有( )| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
分析 Ba2++SO42-═BaSO4↓表示可溶性钡盐或者氢氧化钡与可溶性硫酸盐或者硫酸反应只生成硫酸钡沉淀,据此解答.
解答 解:A.BaCl2溶液与稀硫酸反应,反应实质为钡离子与硫酸根离子生成硫酸钡,离子方程式:Ba2++SO42-═BaSO4↓,故A正确;
B.Ba(OH)2溶液与Na2SO4溶液反应,离子方程式:Ba2++SO42-═BaSO4↓,故B正确;
C.Ba(OH)2溶液与NaHSO4溶液反应,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.Ba(NO3)2溶液与MgSO4溶液反应,离子方程式:Ba2++SO42-═BaSO4↓,故D正确;
故选:C.
点评 本题考查了离子方程式书写,明确离子方程式书写方法及离子方程式的意义是解题关键,题目难度不大.

练习册系列答案
相关题目
5.室温下,甲、乙两烧杯盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
9.原子序数逐渐增大的元素A、B、C、D、E、F的有关信息如下:
根据以上表格信息回答:
(1)元素F在周期表中的位置是第四周期IB族,E形成的低价离子的电子排布式为1s22s22p63s23p63d10.
(2)A、C的氢化物沸点较高的是(用所形成的氢化物表示)H2O,A、B、C的第一电离能大小顺序是(用元素符号表示)N>O>C.
(3)A与氢元素形成的A2H2含有的σ键、π键数目之比为3:2.
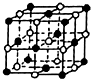
(4)KCl的晶胞如图:“●K,○Cl”,则该晶胞中含K+为4个,已知晶胞参数为:629.8pm(1pm=10-12m),求KCl晶体的密度为$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3(只写出表达式,不要求计算结果).
(5)用惰性电极电解FCl2溶液时,在阴极除了析出红色固体外,还析出白色固体,经检验白色固体为FCl,请写出析出白色固体的阴极反应式Cu2++Cl-+e-=CuCl.
| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |
(1)元素F在周期表中的位置是第四周期IB族,E形成的低价离子的电子排布式为1s22s22p63s23p63d10.
(2)A、C的氢化物沸点较高的是(用所形成的氢化物表示)H2O,A、B、C的第一电离能大小顺序是(用元素符号表示)N>O>C.
(3)A与氢元素形成的A2H2含有的σ键、π键数目之比为3:2.
(4)KCl的晶胞如图:“●K,○Cl”,则该晶胞中含K+为4个,已知晶胞参数为:629.8pm(1pm=10-12m),求KCl晶体的密度为$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3(只写出表达式,不要求计算结果).

(5)用惰性电极电解FCl2溶液时,在阴极除了析出红色固体外,还析出白色固体,经检验白色固体为FCl,请写出析出白色固体的阴极反应式Cu2++Cl-+e-=CuCl.
19.下列排列顺序正确的是( )
| A. | 熔点:Li>Cs>Na | B. | 微粒半径:Ca2+>C1->Mg2+ | ||
| C. | 碱性:KOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:Cu2+>Fe3+>K+ |
6.在实验室中,下列除杂(括号内物质为杂质)的方法正确的是( )
| A. | 溴苯(溴):加入KI溶液,振荡,分液 | |
| B. | 乙烷(乙烯):通过盛有KMnO4溶液的洗气瓶 | |
| C. | 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液 | |
| D. | 乙烯(SO2):通过盛有溴水的洗气瓶 |
3.几种短周期元素的原子半径和主要化合价见下表,下列有关说法正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q在常温下不易反应 | |
| C. | 最高价氧化物的水化物的酸性:L>Z | |
| D. | M单质容易形成离子化合物 |
4.下列几组物质的名称、化学式、所属类别与颜色不一致的是( )
| A. | 胆矾 CuSO4•5H2O 盐 蓝色 | |
| B. | 生石灰 CaO 氧化物 白色 | |
| C. | 纯碱 NaOH 碱 白色 | |
| D. | 盐酸 HCl 酸 无色 |