题目内容
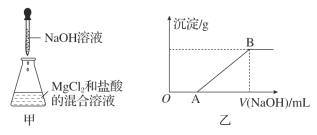
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是_______。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。罐壁内凹而瘪的原因是_____________,离子方程式可能为____________________;罐再鼓起的原因是________________,离子方程式可能为________________。
【答案】1:2:3 3:2:2 CO2被吸收而被外界大气压压瘪 2OH-+CO2=CO32-+H2O 由于铝与碱反应生成H2,压强增大而重新鼓起 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
(1)相同物质的量的钠、镁、铝与足量盐酸反应,金属完全反应,根据电子转移守恒可知,生成氢气体积之比等于金属提供电子物质的量之比;
根据反应物的量先判断金属与酸哪种过量,按不足量计算生成氢气的物质的量,钠与酸反应完会继续与水反应,结合关系式计算;
(1)酸反应时,1mol钠可以提供1mol电子,1mol镁可以提供2mol电子,1mol铝可以提供3mol电子,故生成的氢气体积比为1:2:3;0.3 mol的钠投入到100 mL 1 mol·L-1的硫酸溶液中,钠可以完全反应,根据电子守恒可知生成的氢气为0.15mol;0.3 mol的镁投入100 mL 1 mol·L-1的硫酸溶液,硫酸的量不足,因此生成的氢气根据硫酸的量来计算,为0.1mol;0.3 mol的铝投入100 mL 1 mol·L-1的硫酸溶液中,硫酸的量不足,因此生成的氢气根据硫酸的量来计算,为0.1mol;故生成的氢气体积比为3:2:2;
故答案为:1:2:3;3:2:2;
(2)罐壁内凹而瘪是因为罐内CO2与NaOH发生反应,气体减少导致罐内压强降低,被大气压压瘪;由于易拉罐的材料为铝,铝可与氢氧化钠溶液反应生成氢气,气体增多导致罐内压强升高。
故答案为:CO2被吸收而被外界大气压压瘪;![]() ;由于铝与碱反应生成H2,压强增大而重新鼓起;
;由于铝与碱反应生成H2,压强增大而重新鼓起;![]() 。
。

【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
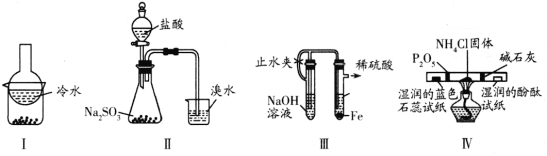
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D