题目内容
【题目】现使用酸碱中和滴定法测定市售白醋(主要成分是CH3COOH)的总酸量(g·100 mL-1)。已知CH3COOH + NaOH===CH3COONa + H2O 终点时所得溶液呈碱性。
Ⅰ.实验步骤:
(1)用移液管量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100mL__________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用_____取待测白醋溶液20.00 mL于锥形瓶中。
(3)滴加2滴_____________作指示剂。
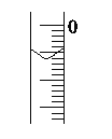
(4)读取盛装0.100 0 mol·L-1NaOH 溶液的碱式滴定管的初始读数。 如果液面位置如图所示,则此时的读数为________mL。
(5)滴定,当__________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)根据上述数据分析得c(市售白醋)=________mol·L-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______(填写序号)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
【答案】容量瓶 酸式滴定管 酚酞 0.60ml 溶液由无色恰好变为浅红色,并在30s内不恢复到原来的颜色 0.75 DE
【解析】
依据中和滴定原理,确定所需仪器、药品、实验步骤,关注每步操作要领及意义。
Ⅰ.(1)用移液管量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,故答案为:容量瓶;
(2)醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋,故答案为:酸式滴定管;
(3)食醋与NaOH反应生成了强碱弱酸盐醋酸钠,由于醋酸钠溶液显示碱性,可用酚酞作指示剂,则用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞,故答案为:酚酞;
(4)视线与凹液面最低点相切的滴定管液面的读数0.60mL,故答案为:0.60;
(5)NaOH滴定食醋的终点为溶液由无色恰好变为红色,并在半分钟内不褪色,故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去,3次消耗NaOH溶液的体积为:15.00mL、15.05mL、14.95mL,则NaOH溶液的平均体积为15.00mL;设10.00 mL食用白醋为c mol·L-1,稀释后20mL白醋的浓度为c1 mol·L-1,则
CH3COOOH ~ NaOH
1mol 1mol
c1mol·L×0.02L 0.1000mol/L×0.015L
解得c1=0.075 mol·L-1,由稀释定律可得0.1L×0.075 mol·L=0.01L×cmol·L,解得c=0.75 mol·L-1,故答案为:0.75 mol·L-1;
(2)浓度误差分析,依据c(待测)= c(标准)V(标准)/ V(待测)进行分析。
A项、碱式滴定管在滴定时未用标准NaOH溶液润洗,会使得标准NaOH溶液浓度减小,造成V(标准)偏大,实验结果偏大,故A错误;
B项、碱式滴定管的尖嘴在滴定前有气泡,滴定后误气泡,造成V(标准)偏大,测定结果偏大,故B错误;
C项、锥形瓶中加入待测白醋溶液后,再加少量水,待测液的物质的量不变,对V(标准)无影响,故C错误;
D项、锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量减小,造成V(标准)减小,测定结果偏小,故D正确;
E项、滴定终点读数时俯视度数,读出的最终标准液体积偏小,则消耗标准液体积偏小,测定结果偏低,故D正确;故答案为:DE。

【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1