题目内容
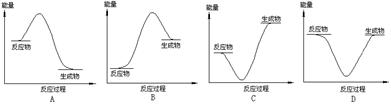
下列反应过程中的能量变化与下图一致的是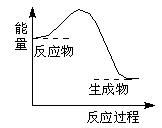
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.C+CO2 2CO 2CO |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
D.C+H2O CO+H2 CO+H2 |
A
解析试题分析:按反应过程中热量的变化,通常把化学反应分为放热反应、吸热反应。①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量,常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等。②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量,常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等、A、铝热反应属于放热反应,反应物具有的总能量高于生成物具有的总能量,故A选项正确;B、碳与二氧化碳反应生成一氧化碳属于吸热反应,反应物具有的总能量低于生成物具有的总能量,故B选项错误;C、碳酸钙分解生成吸热反应,反应物具有的总能量低于生成物具有的总能量,故C选项错误;D、碳和水蒸气反应属于吸热反应,生成物具有的总能量高于反应物具有的总能量,故D选项不正确,故选A。
考点:考查物质发生化学变化时的能量变化

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则CO(g)+H2O(g)
 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H= (3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=___________
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
关于下图所示转化关系(X代表卤素),说法不正确的是
| A.2H(g) +2X(g) ="=" 2HX(g) ΔH3<0 |
| B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
下列化学反应属于吸热反应的是
| A.碘的升华 | B.生石灰溶于水 |
| C.镁与稀盐酸反应 | D.熟石灰与NH4Cl晶体混合制氨 |
下列反应属于放热反应的是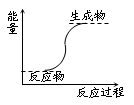
| A.氢氧化钡晶体和氯化铵晶体的反应 |
| B.能量变化如图所示的反应 |
| C.化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D.燃烧反应和中和反应 |
国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。下列说法不正确的是( )
| A.钠米金属燃料,更易点燃 |
| B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离 |
| C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果 |
| D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量 |
已知298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
| A.Q1=Q3=197kJ | B.Q1=Q3<197kJ |
| C.Q1=2Q2 <197kJ | D.Q2<Q1<197kJ |
下列关于反应能量的说法正确的是( )
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)ΔH=-216 kJ/mol,则反应物总能量大于生成物总能量 |
| B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定 |
| C.101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |