题目内容
关于下图所示转化关系(X代表卤素),说法不正确的是
| A.2H(g) +2X(g) ="=" 2HX(g) ΔH3<0 |
| B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
C
解析试题分析:A、根据盖斯定律,ΔH1=ΔH2+ΔH3,氢气在卤素单质中燃烧是放热反应,ΔH1<0,分子断键成为原子需要吸收能量,所以ΔH2>0,ΔH3=ΔH1-ΔH2<0,正确;B、根据盖斯定律,途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3,正确;C、Cl、Br、I的非金属性依次减弱,单质的稳定性逐渐减弱,途径Ⅱ吸收的热量依次减弱,错误;D、途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl能量低,比HBr稳定,正确,答案选C。
考点:考查盖斯定律的理解应用,物质稳定性的比较

已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 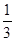 CO(g)
CO(g)
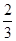 Fe3O4(s)+
Fe3O4(s)+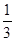 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能、太阳能的转换),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能直接转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
下列说法中正确的是( )
| A.伴有能量变化的物质变化都是化学变化 | B.物质发生化学反应一定伴随着能量变化 |
| C.吸热反应在常温下不能发生 | D.放热反应的发生无需任何条件 |
石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知12 g石墨完全转化成金刚石时,要吸收1.9 kJ的能量。下列说法正确的是( )
| A.石墨不如金刚石稳定 |
| B.由金刚石制备石墨是吸热反应 |
| C.等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多 |
| D.等质量的石墨与金刚石完全燃烧,石墨放出的能量更多 |
下列反应过程中的能量变化与下图一致的是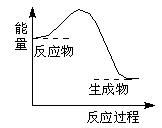
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.C+CO2 2CO 2CO |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
D.C+H2O CO+H2 CO+H2 |
已知热化学方程式:SO2(g)+ 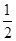 O2(g)
O2(g)  SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +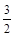 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) +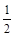 O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |