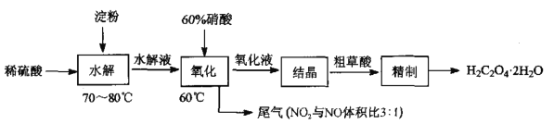
题目内容
【题目】用![]() 表示阿伏加得罗常数,下列说法不正确的是
表示阿伏加得罗常数,下列说法不正确的是
A.对于![]() ,每当新形成
,每当新形成![]() 个
个![]() 键,需要断开
键,需要断开![]() 个
个![]() 键
键
B.![]() 熔融的
熔融的![]() 中含有的阳离子数为
中含有的阳离子数为![]()
C.次氯酸光照分解产生![]() 气体
气体![]() 标准状况
标准状况![]() 转移的电子数为
转移的电子数为![]()
D.电解精炼铜时,若阴极析出32g铜,则转移的电子数为![]()
【答案】C
【解析】
A.对于![]() ,每当形成
,每当形成![]() 个
个![]() 键,需要形成
键,需要形成![]() 二氧化硅,反应消耗了
二氧化硅,反应消耗了![]() 硅原子;由于1mol硅原子形成了4个共价键,根据均摊法,1mol硅原子形成了
硅原子;由于1mol硅原子形成了4个共价键,根据均摊法,1mol硅原子形成了![]() 键,所以反应
键,所以反应![]() 硅需断开1mol硅硅键,即断裂
硅需断开1mol硅硅键,即断裂![]() 个
个![]() 键,故A正确;
键,故A正确;
B.![]() 熔融的
熔融的![]() 的物质的量为
的物质的量为![]() ,
,![]() 熔融硫酸氢钠电离出
熔融硫酸氢钠电离出![]() 钠离子和
钠离子和![]() 硫酸氢根离子,所以含有的阳离子数为
硫酸氢根离子,所以含有的阳离子数为![]() ,故B正确;
,故B正确;
C.发生反应![]() ,产生的气体为HCl、
,产生的气体为HCl、![]() ,生成混合气体的物质的量为
,生成混合气体的物质的量为![]() ,故生成氧气的物质的量为
,故生成氧气的物质的量为![]() ,反应中氧元素化合价由
,反应中氧元素化合价由![]() 价升高为0价,故转移电子数目为
价升高为0价,故转移电子数目为![]() ,故C错误;
,故C错误;
D.电解精炼铜时,阴极反应:![]() ,所以当阴极质量增重32g即析出
,所以当阴极质量增重32g即析出![]() 铜时,转移的电子的物质的量为1mol,则阴极得到的电子数为
铜时,转移的电子的物质的量为1mol,则阴极得到的电子数为![]() ,故D正确;
,故D正确;
故选:C。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
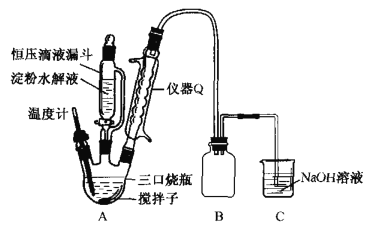
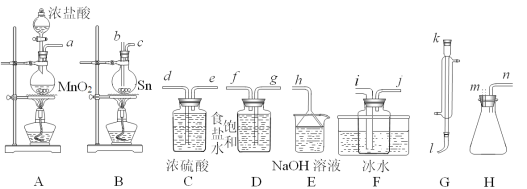
综合自测系列答案【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。
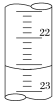
(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |