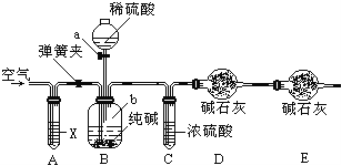
题目内容
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。

(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
【答案】 第三周期第IVA族 1:2 蒸馏或分馏 HCl SiCl4+3H2O=H2SiO3↓+4HCl或3SiCl4+4H2O=H3SiO4↓+4HCl 3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O 0.80或80.00%
【解析】(1)硅是14号元素,在周期表中位于第三周期第IVA族,反应1为二氧化硅和碳的反应:SiO2+3C![]() SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
(2)SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃),由于沸点差别较大,可以通过分馏除去杂质;氯化氢与粗硅反应生成SiHCl3,SiHCl3与氢气又反应生成硅和氯化氢,氯化氢可以循环利用,故答案为:分馏;HCl;
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,SiCl4遇水剧烈反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl,故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,说明生成了一氧化氮,反应的化学方程式为3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O,故答案为:3Si+4HNO3+18HF =3H2SiF6+4NO↑+8H2O;
(5)100吨纯度为75%的石英砂中含有二氧化硅的质量为75t,其中含有硅元素75t×![]() =35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=
=35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=![]() ×100%=80.00%,故答案为:80.00%。
×100%=80.00%,故答案为:80.00%。

 阅读快车系列答案
阅读快车系列答案