题目内容
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
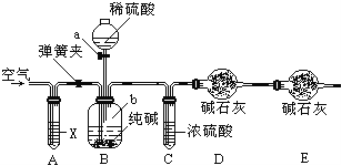
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
【答案】将装置内残留的二氧化碳全部排出,达到精确测量的目的 NaOH 偏大 CO32﹣+2H+═H2O+CO2↑ 88.3%
【解析】
(1)据实验目的来分析装置A中碱液的作用;
(2)据装置C的作用可以知道对测定结果的影响;
(3)据酸与盐的反应规律,反应物、生成物可写出反应的离子方程式;
(4)分析实验前后装置D质量变化,并由此质量差来计算样品中碳酸钠的质量,求出样品中碳酸钠的质量分数。
(1)根据题意可以知道我们是通过测定二氧化碳的质量来测定碳酸钠的质量分数的,所以要排除空气中的二氧化碳干扰实验结果,而在A中装了碱性溶液来吸收空气中的二氧化碳,故装置A中试剂可选用NaOH;
因此,本题正确答案是:将装置内残留的二氧化碳全部排出,达到精确测量的目的;NaOH;
(2)浓硫酸具有吸水性,在C装置中吸收由B装置排出气体中混有的水蒸气,若少了此装置则会使气体中的水蒸气被D装置中碱石灰吸收,而使测定质量偏大,故填偏大;
因此,本题正确答案是:偏大;
(3)据酸与盐的反应规律,稀硫酸和碳酸钠反应的离子方程式为:CO32﹣+2H+═H2O+CO2↑,
因此,本题正确答案是:CO32﹣+2H+═H2O+CO2↑;
(4) 反应中放出二氧化碳的质量为:87.6g-85.4g=2.2g,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106g 44g
m 2.2g
m=![]() =5.3g,
=5.3g,
纯碱样品中碳酸钠的质量分数为:![]() ×100%=88.3%,
×100%=88.3%,
因此,本题正确答案是:88.3%.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案


