题目内容
【题目】下表为周期表的一部分,其中的编号代表对应的元素,用化学用语回答以下问题。
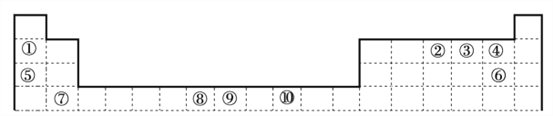
(1)其中属于过渡元素的是_____________,比较②的氢化物与同族第3、4周期元素所形成的氢化物沸点高低并说明理由_____________
(2)②与③中第一电离能较小的元素是_____________;①和④形成的物质与⑤和⑥形成的物质晶体中熔点较高的是_____________。
(3)①形成的有机试剂在有机合成中有重要应用,但极易与O2、CO2等反应。下列说法不正确的是_____________(填字母序号)
a.CO2中键σ与π键的数目之比为1:1
b.游离态和化合态①元素均可由特征发射光谱检出
c.叔丁基锂([(CH3)3C]Li)中碳原子的杂化轨道类型为sp3和sp2
(4)如图一是上述元素形成的物质晶胞结构示意图,其化学式为_____________,其中Fen+的基态电子排布式为_____________,PO43-的空间构型为_____________
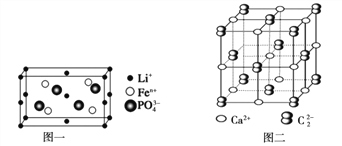
(5)金属①的晶体为体心立方晶胞,其配位数为_____________;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是_____________
(6)上述元素形成的CaC2晶体的晶胞结构与NaCl晶体的相似(如图二所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长(粒子间距增加)。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____________
【答案】 Mn Fe Ni NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高 O LiF c LiFePO4 [Ar]3d6 正四面体 8 ![]() 4
4
【解析】由上述周期表可知:①为Li ②为N ③为O ④为F ⑤为Na ⑥为 Cl;⑦ Ca ⑧Mn ⑨Fe ⑩Ni。
(1)其中属于过渡元素的是⑧Mn ⑨Fe ⑩Ni 三种元素,第VA族元素的氢化物沸点由高到低排列为NH3>AsH3>PH3,原因是NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高;正确答案:Mn 、Fe 、Ni;NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高。
(2)因为N原子核外电子排布为1s22s22p3, p轨道为半充满状态,属于稳定状态,因此第一电离能大于相邻的氧原子的第一电离能,①和④形成的物质氟化锂,离子化合物,⑤和⑥形成的物质为氯化钠,属于离子化合物;组成相似的离子化合物,离子半径越小,离子键越大,物质的熔点就越高,离子半径:Li+ > Na+ 、 F- > Cl-。所以LiF熔点较高;正确答案:O; LiF。
3)CO2中结构简式为![]() ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键; a正确;每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出;b正确;叔丁基锂
键; a正确;每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出;b正确;叔丁基锂![]() 中碳原子的杂化轨道数目均为4,碳原子采取sp3杂化,c错误;正确选项c。
中碳原子的杂化轨道数目均为4,碳原子采取sp3杂化,c错误;正确选项c。
(4)如图一是上述元素形成的物质晶胞结构示意图,含有Li+个数为8×1/8+4×1/2+4×1/4=4,PO43-个数为4,Fe2+个数为4,所以该物质化学式为 LiFePO4;0其化学式为 LiFePO4 ;Fe基态电子排布[Ar] 3d64s2,Fe2+的基态电子排布式为[Ar]3d6 ;![]() 中P原子孤电子对数
中P原子孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,空间构型为正四面体;正确答案:LiFePO4;[Ar]3d6;正四面体。
,空间构型为正四面体;正确答案:LiFePO4;[Ar]3d6;正四面体。
(5)金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;计算晶胞中Li原子数目为![]() ,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的
,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的![]() 倍,设Li原子半径为r,则r=√3 a /4, 晶胞的体积为a 3pm3,原子的体积为2×4/3π×(√3 a /4)3,故原子的空间占有率[2×4/3π×(√3 a /4)3]÷a 3=√3/8π×100%;正确答案:8;3/8π×100%。
倍,设Li原子半径为r,则r=√3 a /4, 晶胞的体积为a 3pm3,原子的体积为2×4/3π×(√3 a /4)3,故原子的空间占有率[2×4/3π×(√3 a /4)3]÷a 3=√3/8π×100%;正确答案:8;3/8π×100%。
(6)有图像可知,CaC2晶体的晶胞结构与NaCl晶胞结构的基础上沿竖直方向拉长,所以距离中心Ca2+最近的C22-

 阅读快车系列答案
阅读快车系列答案【题目】对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。如:纯净物根据其组成和性质可进行如下分类。
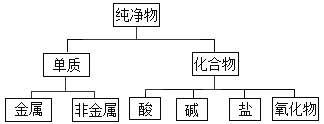
(1)如图所示的分类方法属于_______________。
(2)某化学兴趣小组对下列四组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
C.FeCl3溶液、蒸馏水、CaCO3悬浊液、Fe(OH)3胶体
D.NaOH、KOH、Ba(OH)2、Fe2O3
①填写下列空白:
A组 | B组 | C组 | D组 | |
分类标准 | 含氧酸 | ________ | 分散系 | ________ |
不属于该类别的物质 | ________ | Na2CO3 | ________ | Fe2O3 |
②写出①表中发生反应的化学方程式:
A+ B→气体__________________________;A+D__________________________。