��Ŀ����
����Ŀ����������ǧ��ƵĻ�ѧ���ʺ���˷ḻ�Ļ�ѧ�仯�����෨�����ü�����������ġ��磺�������������ɺ����ʿɽ������·��ࡣ
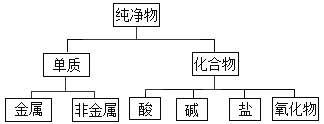
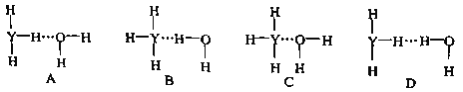
(1)��ͼ��ʾ�ķ��������_______________��
(2)ij��ѧ��ȤС��������������ʽ����о���
A��HCl��H2SO4��H2CO3��HNO3
B��Na2CO3��NaNO3��AgNO3��Ba(NO3)2
C��FeCl3��Һ������ˮ��CaCO3����Һ��Fe(OH)3����
D��NaOH��KOH��Ba(OH)2��Fe2O3
����д���пհף�
A�� | B�� | C�� | D�� | |
����� | ������ | ________ | ��ɢϵ | ________ |
�����ڸ��������� | ________ | Na2CO3 | ________ | Fe2O3 |
��д���ٱ���������Ӧ�Ļ�ѧ����ʽ��
A+ B������__________________________��A+D__________________________��
���𰸡���״���෨ HCl ������ ����ˮ �� 2HCl + Na2CO3��2NaCl+ CO2��+ H2O 6HCl + Fe2O3��2FeCl3+3H2O
��������
��1����״���෨��һ�ֺ�����ķ��෨�����ղ�Σ�һ��һ�����֣�����һ�Ŵ�������Ҷ��֦���ˡ�����ͼʾ����������״���෨���ʴ�Ϊ����״���෨��
��2����A����HClΪ�����ᣬ�����������Ǻ����ᣬ����A���в����ں��������HCl��
B����NaNO3��AgNO3��Ba(NO3)2 �����������Σ�Na2CO3����̼���β����������Σ�����B���в����������ε���Na2CO3��C���з�ɢϵ�ǻ�������ˮΪ���������C���в����ڷ�ɢϵ��������ˮ��D����NaOH��KOH��Ba(OH)2�����ڼFe2O3�������������D���в����ڼ����Fe2O3��
�ʴ�Ϊ��HCl��Na2CO3������ˮ��Fe2O3��
��A+ B������Ļ�ѧ����ʽΪ��2HCl + Na2CO3��2NaCl+ CO2��+ H2O��A+D��Ӧ�ķ���ʽΪ��6HCl + Fe2O3��2FeCl3+3H2O���ʴ�Ϊ��2HCl + Na2CO3��2NaCl+ CO2��+ H2O��6HCl + Fe2O3��2FeCl3+3H2O��

����Ŀ��Bodensteins�о���ӦH2(g)��I2(g)![]() 2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
������� | ��ʼ���� | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2��0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
�о�����������Ӧ�У�v����ka��w(H2)��w(I2)��v����kb��w2(HI)������ka��kbΪ����������˵����ȷ���ǣ�
A. �¶�ΪTʱ���÷�Ӧ![]() = 64
= 64
B. ����I����ǰ20 min��ƽ������v(HI)=0.0125 mol��L��1��min��1
C. ����ʼʱ������I�м������ʵ�����Ϊ0.1 mol��H2��I2��HI����Ӧ�������
D. ���������д���ka��=ka����kb��=kb������x��ֵһ��Ϊ1