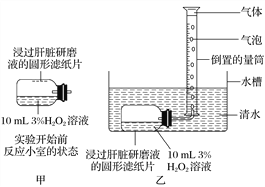
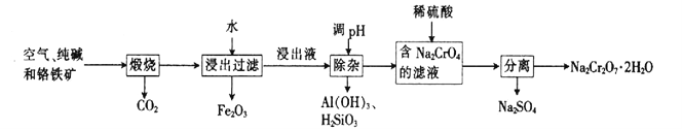
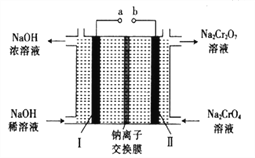
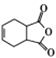
题目内容
【题目】常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是
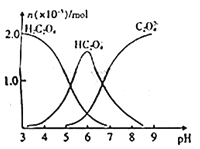
A. 当V(NaOH溶液)<10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液)=15mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
【答案】D
【解析】当V(NaOH溶液)<10mL时,溶液中溶质为NaHC2O4 和H2C2O4,溶液显酸性,根据电荷守恒规律:c(Na+)+ c(H+)=2c(C2O42-)+c(HC2O4-)+ c(OH-),由于c(H+)> c(OH-),所以c(Na+)<2c(C2O42-)+c(HC2O4-),A错误;当V(NaOH溶液)=10mL时,反应后溶质为NaHC2O4 HC2O4-在溶液中水解程度小于电离程度,溶液呈酸性,抑制了水的电离,则溶液中水的电离程度比纯水小,B错误;当V(NaOH溶液)=15mL时,溶质为等浓度的![]() 和
和![]() ,溶液呈酸性,则
,溶液呈酸性,则![]() 、
、![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,C错误;当V(NaOH溶液)=20mL时,与氢氧化钠溶液恰好反应,溶液中溶质为
,C错误;当V(NaOH溶液)=20mL时,与氢氧化钠溶液恰好反应,溶液中溶质为![]() ,图象分析可以知道溶液呈碱性,根据质子守恒可以知道: c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-),D正确;正确选项D。
,图象分析可以知道溶液呈碱性,根据质子守恒可以知道: c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-),D正确;正确选项D。

【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度