题目内容
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子。用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为____________________。
(2)Q元素在元素周期表中属于____区,与Y元素同族的第四周期元素的价电子排布式为______。
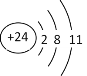
(3)RY2的电子式为________________,Z3+的离子结构示意图为____________。
(4) 由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质。该反应的离子方程式为______。
【答案】N>O>C s 4s24p4 ![]()
 2Cr2O72-+ 3CH3CH2OH+16H+
2Cr2O72-+ 3CH3CH2OH+16H+ ![]() 4Cr3++3CH3COOH+11H2O
4Cr3++3CH3COOH+11H2O
【解析】
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,①Q为元素周期表中原子半径最小的元素,则Q为H元素;②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1s、2s、2p能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;R、X、Y原子序数依次增大,故X为氮;④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,Z的原子序数是24,所以Z为Cr元素,综上可知Q为氢元素、R为碳元素、X为氮元素、Y为氧元素、Z为铬元素。
(1)C、N、O的第一电离取决于元素非金属性的强弱,但是由于N的2p能级上电子处于半充满的相对稳定状态,故C、N、O的第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(2)Q元素为H,H在元素周期表中属于第一周期第ⅠA族,即s区;Y为O元素,与O元素同族(最外层电子数为6)的第四周期元素的价电子排布式为为4s24p4,故答案为:s;4s24p4;
(3)RY2为CO2,二氧化碳中,C与O形成两对共用电子对,故电子式为:![]() ;Z3+为Cr3+,Cr3+的离子结构示意图为:
;Z3+为Cr3+,Cr3+的离子结构示意图为: ,故答案为:
,故答案为:![]() ;
; ;
;
(4)O、Cr两种元素组成的离子为Cr2O72-,Cr2O72-在酸性条件下具有强氧化性,可将乙醇直接氧化为反应乙酸,本身被还原为Cr3+,反应的离子方程式为2Cr2O72-+3CH3CH2OH+16H+→4Cr3++3CH3COOH+11H2O,故答案为:2Cr2O72-+3CH3CH2OH+16H+→4Cr3++3CH3COOH+11H2O。

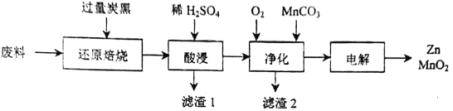
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
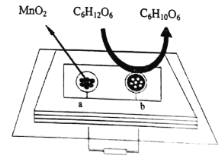
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。