题目内容
13.纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6mol/L盐酸 d.氯化铵e.氢氧化钙.
(1)A中制备气体时,所需药品是(选填字母序号):ac;
(2)B中盛有饱和碳酸氢钠溶液,其作用是:除去二氧化碳中的氯化氢;
(3)写出制取实验室氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式:NH3;
(5)检验D出口处是否有氨气逸出的方法是:用湿润的红色石蕊试纸放到D出口处,如果试纸变蓝,则氨气逸出,反之则不逸出,或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气则氨气逸出,反之则不逸出;
(6)写出制纳米级碳酸钙的化学方程式:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:将少量碳酸钙加水充分搅拌,用一束可见光照射,观察是否发生丁达尔现象,若有丁达尔现象则为纳米级,若没有丁达尔现象则不是纳米级.
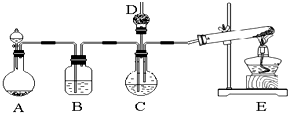
分析 (1)根据装置特点可知A为二氧化碳的发生装置,E为氨气的发生装置;
(2)装置B目的是除掉挥发出来的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热制的生成氯化钙、氨气和水;
(4)根据二氧化碳和氨气的溶解性判断先通入的气体;
(5)根据氨气的检验方法;
(6)由反应物和生成物写出反应方程式.
(7)将少量碳酸钙加水充分搅拌,看是否有丁达尔效应.
解答 解:(1)装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,故答案为:ac;
(2)饱和NaHCO3溶液可除掉挥发出来的氯化氢,故答案为:除去二氧化碳中的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热制的生成氯化钙、氨气和水,方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气,故答案为:NH3;
(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,
故答案为:用湿润的红色石蕊试纸放到D出口处,如果试纸变蓝,则氨气逸出,反之则不逸出,或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气则氨气逸出,反之则不逸出;
(6)氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,
故答案为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(7)将少量碳酸钙加水充分搅拌,看是否有丁达尔效应,若有丁达尔效应,则说明为纳米级,
故答案为:将少量碳酸钙加水充分搅拌,用一束可见光照射,观察是否发生丁达尔现象,若有丁达尔现象则为纳米级,若没有丁达尔现象则不是纳米级.
点评 本题考查了氨气的实验室制法以及物质含量的测定,难度不大,掌握实验的原理是解题的关键.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0).在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1=3200.根据表中数据判断,温度T1和T2的关系是(填序号)A.
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)在一个体积为1L的真空容器中,加入0.5mol CaCO3,T℃时,发生反应:CaCO3(s)?CaO(s)+CO2(g),测得c(CO2)=0.2mol/L.温度不变,压缩容积为0.5L,则c(CO2)的变化范围为:0.2mol/L≤c(CO2)<0.4mol/L.
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8kJ/mol和283.0kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol -1.
(4)氨硼烷(H3BNH3)一种具有潜在应用前景的氢存储介质,吸收H2后的氨硼烷作电池负极材料(用MH表示),利用其产生的电能进行硫酸铜溶液的电解实验,如图所示.
①电池放电时,负极的电极反应式为MH+OH--e-═M+H2O
②若电流表的指针指向500mA,假设电流强度不变,当电解池中的Cu2+完全析出,理论上需要时间3.86×104s( 法拉第常数F=9.65×104C•mol-1)
| A. | 2 | B. | 8 | C. | 18 | D. | 32 |
| A. | 1.4 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.7 mol•L-1 | D. | 0.5mol•L-1 |

 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.