题目内容
9. 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:(1)反应需在50~60℃的温度下进行,图中给反应物加热的方法是水浴加热,其优点是便于控制温度和受热均匀.
(2)在配制混合酸时应将浓硫酸加入到浓硝酸中去.
(3)该反应的化学方程式:
 .
.(4)由于装置的缺陷,该实验可能会导致的不良后果是:苯、浓硝酸等挥发到空气中,造成污染.
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:
①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%NaOH溶液洗
⑤水洗.正确的操作顺序是B.
A.①②③④⑤B.②④⑤③①C.④②③①⑤D.②④①⑤③
分析 (1)图中给反应物加热的方法是水浴加热,水浴加热便于控制温度,受热均匀;
(2)配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水;
(4)由于苯和硝酸都是易挥发、有毒的物质,设计实验时应考虑它们可能产生的污染和由挥发导致的利用率降低;
(5)产品精制,应先水洗,溶解混有的酸,再加入碱中和,然后水洗、干燥,最后蒸馏.
解答 解:(1)图中给反应物加热的方法是水溶加热,水域加热便于控制温度,受热均匀,
故答案为:水浴加热;便于控制温度、受热均匀.
(2)配制混合酸时应将密度大的浓硫酸加入到密度小的浓硝酸中去,配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人,
故答案为:浓硫酸、浓硝酸;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水,反应方程式为: ,
,
故答案为: .
.
(4)由于苯和硝酸都是易挥发、有毒的物质,应考虑它们可能产生的污染和由挥发导致的利用率降低,装置缺少冷凝回流装置,
故答案为:苯、浓硝酸等挥发到空气中,造成污染.
(5)产品精制,应先水洗,溶解混有的酸,再加入碱中和,然后水洗、干燥,最后蒸馏故正确的顺序为②④⑤③①,
故答案为:B.
点评 本题考查硝基苯制备实验的有关判断,该题是基础性试题的考查,试题注重基础,只要是考查学生对硝基苯制备实验的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
14.实验室利用冰醋酸和正丁醇(CH3CH2CH2CH2OH)制备乙酸正丁酯,实验装置如图所示,可能用到的有关数据如下表:
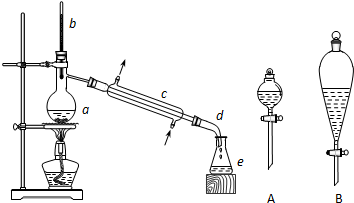
合成反应:在干燥的仪器a中加入9.5g正丁醇、9.2mL 冰醋酸和3~4滴浓硫酸,摇匀后,加几粒沸石,c中通水,开始缓慢加热,控制馏出物的温度不超过130℃.分离提纯:
①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;
②依次用水、少量10%的碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;
③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯9.1g.请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如右图装置中的B(填序号).
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷B.无水硫酸钠C.碱石灰D.氢氧化钠固体
(6)本实验所得到的乙酸正丁酯的产率是61.1%.

| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;
②依次用水、少量10%的碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;
③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯9.1g.请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如右图装置中的B(填序号).
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷B.无水硫酸钠C.碱石灰D.氢氧化钠固体
(6)本实验所得到的乙酸正丁酯的产率是61.1%.
19.分类是学习和研究化学的一种重要思想方法,下列关于物质分类的说法中正确的是( )
| A. | 漂白粉、胆矾都是混合物 | |
| B. | 烧碱、纯碱都是离子化合物 | |
| C. | 二氧化碳、二氧化氮都是酸性氧化物 | |
| D. | 水、氨水都是弱电解质 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
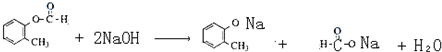
 C6H5COOCH3+H2O.
C6H5COOCH3+H2O.
 .
.
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.