��Ŀ����
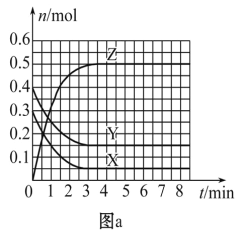
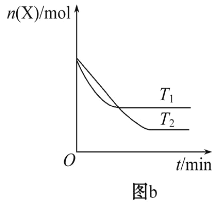
����Ŀ��T0 ��ʱ����2 L���ܱ������з�����Ӧ:X(g)+Y(g)![]() Z(g)(δ��ƽ)�������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1 �桢T2 ��ʱ������Ӧ��X�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ����
Z(g)(δ��ƽ)�������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1 �桢T2 ��ʱ������Ӧ��X�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ����
A. �÷�Ӧ������Ӧ�����ȷ�Ӧ
B. T0 �棬�ӷ�Ӧ��ʼ��ƽ��ʱ:v(X)=0. 083 mol��L-1��min-1
C. ͼa�з�Ӧ�ﵽƽ��ʱ��Y��ת����Ϊ37. 5%
D. T1��ʱ�����÷�Ӧ��ƽ�ⳣ��K=50����T1<T0
���𰸡�D
��������
A.���ݡ��ȹ���ƽ��ֵ���ж��¶ȸߵ�,�ٽ��ƽ�����ʵ�����С�жϷ�Ӧ�����͡�
B.����v=c/t ���㡣
C.��ͼa����֪��Y�����ʵ����仯��Ϊ0.25mol,��ʼʱY�����ʵ���Ϊ0.4mol,������ת���ʵĶ�����㡣
D.�ȸ���ͼaȷ����Ӧ����ʽ,�������T0ʱƽ�ⳣ��,�ٽ�������¶�ƽ�������ȷ�Ӧ�ƶ������жϡ�
�÷�Ӧ�ﵽƽ��״̬ʱ,X���ʵ����ı仯��=��0.3-0.05��=0.25mol��Y���ʵ����ı仯��=��0.4-0.15��=0.25mol,Z���ʵ����ĵı仯��=0.5-0=0.5mol�����������ͬ������ʽ�����ʵ�ϵ���ȵ��ڸ����ʵı仯��֮�ȣ����Ը÷�Ӧ�ķ���ʽΪX(g)+Y(g) 2Z(g)��
A.��ͼb����֪��,�¶�ΪT1��ʱ���ȵ���ƽ��,����T1> T2���¶�Խ����ƽ��ʱX�����ʵ���Ũ��Խ��,˵�������¶�ƽ�����淴Ӧ�ƶ�,�����¶�ƽ�������ȷ�Ӧ�ƶ�,������ӦΪ���ȷ�Ӧ,��A������
B. T0 �棬�ӷ�Ӧ��ʼ��ƽ��ʱ:v(X)=��0.3-0.05��/(2��3)=0.042 mol��L-1��min-1, ��B������
C.��ͼa����֪��,Y����ʼ��Ϊ0.4mol��ƽ��ʱY�����ʵ���Ϊ0.15mol��Y�ı仯��Ϊ0.25mol,����Y��ת����Ϊ0.25/0.4��100%=62.5%����C������
D. ��ͼa����֪��,�¶�ΪT0 ���ƽ��ʱ,X��Y��Z�����ʵ���Ũ�ȷֱ�Ϊ0.025mol/L��0.075mol/L��0.25mol/L,��ӦΪX(g)+Y(g) 2Z(g)����ƽ�ⳣ��K=c2(Z)/ c(X)c(Y)=0.25��0.25/(0.075��0.025)=100/3�������Ϸ�����֪���÷�ӦΪ���ȷ�Ӧ��T1��ʱ��K=50��ƽ�ⳣ���������¶ȣ�ƽ�����ƣ���T1<T0����D��ȷ��
��������������ѡD��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д�����Ŀ��ijͬѧ��������ʵ��:
װ�� |
|
|
���� | ������ָ��δ����ƫת | ������ָ�뷢��ƫת |
����˵���в���ȷ����
A. ����Ƭ�������ձ���������ˮ��������ָ��ᷢ��ƫת
B. ��K3[Fe(CN)3]��Һ������Ƭ��������Һ�����жϵ�ص���������
C. ��Ƭ��ĸ�ʴ���ʲ����
D. ��������ָ��δ����ƫת������Ƭ����Ƭ���δ����ʴ


