题目内容
【题目】铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中有广泛的应用。
(1)普通水泥的主要成分之一是铝酸三钙(3CaO·Al2O3),3CaO·Al2O3中Al的化合价为__________;
(2)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(Al2O3)与炭粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式__________;
(3)现将一定量的铝粉和镁粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的质量的关系如图所示。
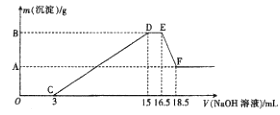
①D→E过程中反应的离子方程式为____________________;
②A点对应纵坐标的数值是__________,原稀硝酸的浓度是__________mol·L-1。
【答案】(1)+3 (2)Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO
(3)①NH4++OH-=NH3↑+H2O ②0.696 0.72
【解析】
试题分析:(1)根据化合物中各元素化合价代数和为零的原则,Al的化合价为+3价;
(2)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2![]() 2AlCl3+3CO;
2AlCl3+3CO;
(3)①由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨;离子方程式为:NH4++OH-=NH3↑+H2O;故答案为:NH4++OH-=NH3↑+H2O;
②由C与D点,氢氧化钠溶液恰好和Fe(NO3)3、Al(NO3)3反应生成NaNO3;
由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨通过上面的分析、根据氮原子守恒可知O点到D点硝酸钠的物质的量=硝酸的物质的量,从D点到E点硝酸的物质=2硝酸钠的物质的量,而硝酸钠的物质的量=氢氧化钠的物质的量,所以硝酸的物质的量=4mol/L×0.015L+2×4mol/L×(0.0165L-0.015L)=0.072mol,
所以原硝酸的物质的量浓度=![]() =0.72mol/L;
=0.72mol/L;
根据EF可知:沉淀减少,说明氢氧化铝溶解,所以氢氧化铝的物质的量=EF线段加入氢氧化钠溶液的物质的量
即:n[Al(OH)3]=4mol/L×(0.0185L-0.0165L)=0.008mol,
根据题意可知:生成0.008mol氢氧化铝沉淀消耗氢氧化钠的物质的量=3×0.008mol=0.024mol
CD段生成沉淀为氢氧化铝和氢氧化镁,
所以生成氢氧化镁消耗氢氧化钠的物质的量=4mol/L×(0.015L-0.003L)-0.024mol=0.024mol
n[Mg(OH)3]=![]() =
=![]() =0.012mol;纵坐标A点的数值即是生成氢氧化镁的质量=0.012mol×58g/mol=0.696g。
=0.012mol;纵坐标A点的数值即是生成氢氧化镁的质量=0.012mol×58g/mol=0.696g。