题目内容
20.下列仪器的使用和实验合理的是(夹持、加热等装置略去)( )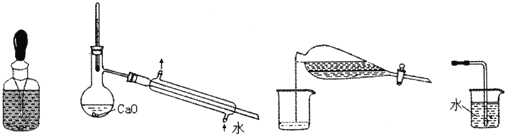
| A. | 储存液溴 | B. | 提纯含少量水的乙醇 | ||
| C. | 分离CCl4和水 | D. | 吸收氨气 |
分析 A.溴易挥发,且溶于橡胶;
B.提纯含少量水的乙醇,加CaO与水反应后增大与乙醇的沸点差异,然后蒸馏;
C.分离CCl4和水,水在上层,先分离出下层液体;
D.氨气极易溶于水.
解答 解:A.溴易挥发,且溶于橡胶,则不能使用胶头滴管密封,故A错误;
B.提纯含少量水的乙醇,加CaO与水反应后增大与乙醇的沸点差异,然后蒸馏,则图中蒸馏装置合理,故B正确;
C.分离CCl4和水,水在上层,先分离出下层液体,再分离上层液体,故C错误;
D.氨气极易溶于水,图中装置可发生倒吸,故D错误;
故选B.
点评 本题考查化学实验方案的评价及实验装置的综合应用,为高频考点,把握物质的性质、装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C[ | 将一定量的NaNO3和KCl的混合液加热并 浓缩至有晶体析出时,趁热过滤 | 得到NaCl晶体 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | C. | C | D. | D |
11.下列有关硅及其化合物的用途及反应,正确的是( )
①二氧化硅可用来制造半导体器件
②硅可用于制造光导纤维
③2C+SiO2═高温═Si+2CO↑
④二氧化硅溶于水制硅酸.
①二氧化硅可用来制造半导体器件
②硅可用于制造光导纤维
③2C+SiO2═高温═Si+2CO↑
④二氧化硅溶于水制硅酸.
| A. | ③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
8.下列气体既易溶于水并且水溶液显碱性的是( )
| A. | NH3 | B. | HCl | C. | SO2 | D. | CH4 |
15.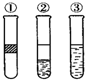 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )| A. | ①是苯,②是CCl4,③是酒精 | B. | ①是酒精,②是CCl4,③是苯 | ||
| C. | ①是CCl4,②是苯,③是酒精 | D. | ①是苯,②是酒精,③是CCl4 |
5. 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.
I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为0.2mol/L•min;T1>T2(选填“>”“<”或“=”),理由是反应放热,温度升高平衡向左移动,反应物转化率低
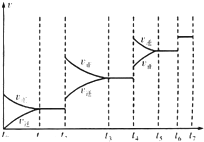
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
10.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
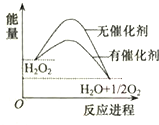

| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2→H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
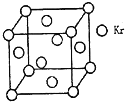 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).