题目内容
12. 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).(1)R在基态时价层电子排布式为3d104s1.
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式Cu+H2O2+2H+=Cu2++2H2O.
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物.测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=3(填数字).
(4)1mol晶体L中含有σ键的数目为2NA.
(5)G与M可形成MG3与MG2,MG3分子的空间构型是平面三角形,MG2中M原子的杂化方式sp2杂化.
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有ac(填字母).
a.离子键 b.氢键 c.配位键 d.金属键.
分析 A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,则A为氢元素;D、G、L、M基态原子的最外能层均有2个未成对电子,外围电子排布为ns2np2或ns2np4,故D为C元素、G为O元素、L为Si元素、M为S元素;E介于C元素与O元素之间,故E为N元素;R+核外有28个电子,则R元素原子质子数为29,故R为Cu,
(1)R为Cu元素,其核外有29个电子,根据其电子排布式分析;
(2)Cu与双氧水在酸性条件下生成铜离子和水;
(3)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×18+6×12=4,然后求出比值;
(4)晶体Si属于原子晶体,晶体中每个Si原子成4个Si-Si键,每个Si-Si键给1个Si提供12,
(5)根据中心原子的价层电子对数判断;
(6)在(NH4)2Cu(SO4)2中存在的化学键除极性键外,[(NH4)2Cu]4+与SO42-之间存在离子键,[(NH4)2Cu]4+中铵根离子与铜离子之间形成配位键.
解答 解:A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,则A为氢元素;D、G、L、M基态原子的最外能层均有2个未成对电子,外围电子排布为ns2np2或ns2np4,故D为C元素、G为O元素、L为Si元素、M为S元素;E介于C元素与O元素之间,故E为N元素;R+核外有28个电子,则R元素原子质子数为29,故R为Cu,
(1)R为Cu元素,其电子排布式为1s22s22p63s23p63d104s1,则在基态时价层电子排布式为3d104s1;
故答案为:3d104s1;
(2)Cu与双氧水在酸性条件下生成铜离子和水,其反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(3)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×18+6×12=4,则mn=124=3,
故答案为:3.
(4)晶体Si属于原子晶体,晶体中每个Si原子成4个Si-Si键,每个Si-Si键给1个Si提供12,故1mol晶体硅中含有δ键的数目为1mol×4×12×NAmol-1=2NA,
故答案为:2NA;
(5)SO3中S原子价层电子对数为3+6−2×32=3,S原子采取sp2杂化,孤电子对为0,为平面三角形;SO2中S原子价层电子对数为2+6−2×22=3,S原子采取sp2杂化,
故答案为:平面三角形;sp2杂化;
(6)在(NH4)2Cu(SO4)2中存在的化学键除极性键外,[(NH4)2Cu]4+与SO42-之间存在离子键,[(NH4)2Cu]4+中铵根离子与铜离子之间形成配位键,
故答案为:ac.
点评 本题考查核外电子排布规律、离子方程式的书写、晶胞、杂化理论、化学键等,难度中等,推断元素是解题的关键,(3)中晶胞计算为易错点,注意仔细观察结构.

| X | Y | 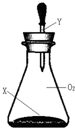 | |
| A | 过量C、Fe碎屑 | 稀HCl | |
| B | 过量Na2CO3粉末 | 稀H2SO4 | |
| C | 过量Fe、Al碎屑 | 浓H2SO4 | |
| D | 过量Cu、CuO粉末 | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 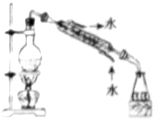 分离Na2CO3溶液和CH3COOC2H5 | B. |  实验室制取少量氨气 | ||
| C. | 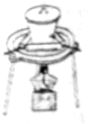 高温煅烧石灰石 | D. | 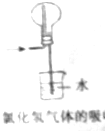 实验室吸收HCl气体 |

| A. | 储存液溴 | B. | 提纯含少量水的乙醇 | ||
| C. | 分离CCl4和水 | D. | 吸收氨气 |
| A. | 将1 mol MnO2加入足量浓盐酸中,加热 | |
| B. | 将l mol Na2O2加入足量水中, | |
| C. | 将1 mol Cu加入足量稀硝酸中,加热 | |
| D. | 将1 mol C加入足量浓硫酸中,加热 |
| A. | 该反应前后氮元素的化合价不变 | |
| B. | 该反应中的四种物质晶体中都存在氢键 | |
| C. | 该反应中NH3、F2、NF3的分子中所有原子均共平面 | |
| D. | 该反应中NH3、F2、NF3三种物质的晶体均属于分子晶体 |

| A. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| B. | 含有两种官能团 | |
| C. | 1mol该有机物与足量钠反应可得到0.5molH2 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
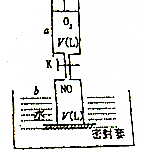 如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下:
如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下: 的物质的量浓度为___________。
的物质的量浓度为___________。