题目内容
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。
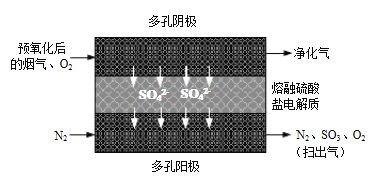
①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。
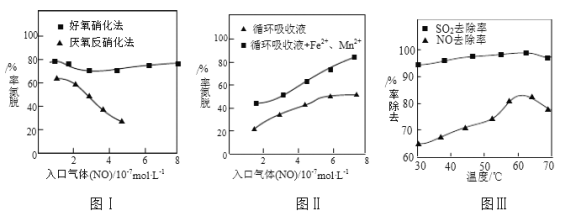
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
【答案】 SO2(g+2H2(g)=S(s)+2H2O(g) ΔH=(a -2b+2c) kJ·mol—1 2SO3+O2+4e—=2SO42— 70 好氧硝化 Fe2+、Mn2+对该反应有催化作用 温度升高,H2O2分解速率加快 2H2O+ClO2-+2SO2=Cl—+2SO42—+4H+
【解析】⑴①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1,②H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1,③H2O(l)= H2O(g) ΔH=c kJ·mol—1,根据盖斯定律,将①-②×2+③×2得:SO2(g+2H2(g)=S(s)+2H2O(g) ΔH=(a -2b+2c) kJ·mol—1,故答案为:SO2(g+2H2(g)=S(s)+2H2O(g) ΔH=(a -2b+2c) kJ·mol—1;
⑵①阴极发生还原反应,根据图示,阴极三氧化硫和氧气反应生成硫酸根离子,反应方程式为2SO3+O2+4e—=2 SO42-,故答案为:2SO3+O2+4e—=2 SO42-;
②转移1mol电子,生成0.5mol SO42-,在阳极发生氧化反应生成三氧化硫和氧气,根据阴极反应方程式2SO3+O2+4e—=2 SO42-,所得“扫出气”中含有0.5molSO3和0.25molO2,用水吸收可以生成0.5molH2SO4,可制得质量分数70%的硫酸的质量为![]() =70g,故答案为:70;
=70g,故答案为:70;
⑶①由图I知,当废气中的NO含量增加时,好氧硝化法脱氮效率高,故答案为:好氧硝化;
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,可能是Fe2+、Mn2+对该反应有催化作用,故答案为:Fe2+、Mn2+对该反应有催化作用;
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,H2O2分解速率加快,NO去除率下降,故答案为:温度升高,H2O2分解速率加快;
②废气中的SO2与NaClO2发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为2H2O+ClO2-+2SO2=Cl—+2SO42-+4H+,故答案为:2H2O+ClO2-+2SO2=Cl—+2SO42-+4H+。

【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
