题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
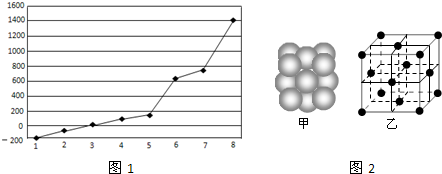
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o |

试回答下列问题:
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
Si
Si
(填元素符号);(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
CO2
CO2
,该分子是由极性
极性
键构成的非极性
非极性
分子(填“极性”或“非极性”);元素d的氧化物的分子式是N2O
N2O
.(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
12
12
,一个晶胞中i原子的数目为4
4
;晶胞中存在两种空隙,分别是正四面体空隙
正四面体空隙
、正八面体空隙
正八面体空隙
.分析:由元素在周期表中的位置可知a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Mg,i为Al,j为Si,k为S,l为Cl,m为Ar,n为K,o为Fe,
(1)熔点最高的应为原子晶体;
(2)原子晶体中,原子的半径越小,共价键键能越大,原子晶体的熔沸点越高;
(3)根据元素的种类确定对应的化合物;
(4)利用均摊发判断.
(1)熔点最高的应为原子晶体;
(2)原子晶体中,原子的半径越小,共价键键能越大,原子晶体的熔沸点越高;
(3)根据元素的种类确定对应的化合物;
(4)利用均摊发判断.
解答:解:(1)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si,故答案为:Si;
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体为SiC,晶型与晶体j相同,都是原子晶体,但由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高,
故答案为:SiC;因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高;
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,应为CO2和N2O,电子数都为22,其中CO2为极性键形成的非极性分子,
故答案为:CO2;极性;非极性;N2O;
(4)晶胞中距离最近的原子为位于定点和面心位置的两个原子,每个定点周围有3×
×8=12个原子,即配位数为12,晶胞中原子位于定点和面心,晶胞中含有Al的个数为8×
+6×
=4,观察晶胞结构可知晶胞中存在两种空隙,分别是正四面体空隙、正八面体空隙.
故答案为:12;4;正四面体空隙;正八面体空隙.
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体为SiC,晶型与晶体j相同,都是原子晶体,但由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高,
故答案为:SiC;因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高;
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,应为CO2和N2O,电子数都为22,其中CO2为极性键形成的非极性分子,
故答案为:CO2;极性;非极性;N2O;
(4)晶胞中距离最近的原子为位于定点和面心位置的两个原子,每个定点周围有3×
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:12;4;正四面体空隙;正八面体空隙.
点评:本题考查较为综合,题目难度较大,涉及晶胞的计算,晶体的比较和分子的极性等问题,易错点为晶胞的计算,注意利用均摊法分析.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
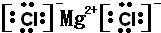
 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是