题目内容
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。如图是某科研小组以含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程:
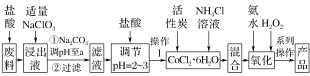
写出加“适量NaClO3”发生反应的离子方程式__________________。
【答案】6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O
【解析】
根据题意可知,本题考查离子方程式的书写和氧化还原反应化合价的变化规律,运用离子方程式的书写步骤和氧化还原反应得失电子守恒规律分析。
(1)加“适量NaClO3”的目的是将Fe2+氧化为Fe3+,发生的离子反应为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
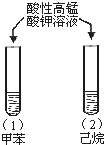
A |
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
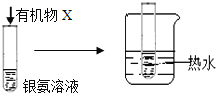
B |
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
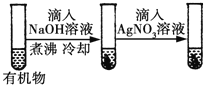
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D