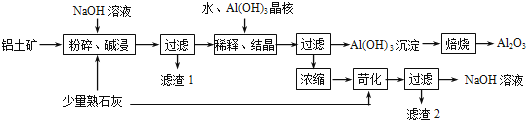
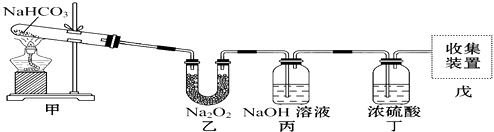
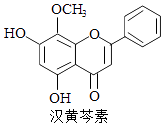
��Ŀ����
����Ŀ����1���ȼҵ�е�ⱥ��ʳ��ˮ��ԭ��ʾ��ͼ����ͼ��ʾ��

��ҺA������������__________����ⱥ��ʳ��ˮ�����ӷ���ʽΪ___________��
��2��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��֪��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2 kJ/mol
CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��+247.4 kJ/mol
�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ_________________��
��3����������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ��ͼ����֪����1mol N��N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�H=_____kJ/mol��

��4����COΪȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ��CO�������������Na2CO3�����ظ����缫��ӦʽΪ_______________�������ĵ缫��ӦʽΪ ____________���ŵ�ʱ��CO32�� �����ص�_______(���������)����
���𰸡� �������� 2Cl-+2H2O![]() 2OH-+H2��+Cl2�� CH4(g)��2H2O(g) ��CO2(g) ��4H2(g) ��H��+165.0 kJ/mol +882 kJ/mol CO+CO32--2e-=2CO2 O2+2CO2+4e-=2CO32- ��
2OH-+H2��+Cl2�� CH4(g)��2H2O(g) ��CO2(g) ��4H2(g) ��H��+165.0 kJ/mol +882 kJ/mol CO+CO32--2e-=2CO2 O2+2CO2+4e-=2CO32- ��
����������1���Ҳ�缫���������������ӷŵ磬ˮ�ĵ���ƽ�ⱻ�ƻ���ͬʱ�����������ƣ�����ҺA�������������������ƣ���ⱥ��ʳ��ˮ�����ӷ���ʽΪ2Cl-+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
��2����֪��
��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2 kJ/mol
��CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��+247.4 kJ/mol
���ݸ�˹���ɿ�֪�١�2���ڼ��õ�CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪCH4(g)��2H2O(g)��CO2(g)��4H2(g) ��H��+165.0 kJ/mol��
��3��N2��������1mol��̬N4�Ļ�ѧ����ʽΪ2N2��N4������ݷ�Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ��֪��H��942kJ/mol��2��167kJ/mol��6��+882 kJ/mol��
��4����������ʧȥ���ӵ�������Ӧ����CO�ڸ����ŵ磬���������ڵ�̼����Ϊ����ʣ����ظ����缫��ӦʽΪCO+CO32--2e-��2CO2�����������õ����ӣ��缫��ӦʽΪO2+2CO2+4e-��2CO32-��ԭ��������������ƶ�����ŵ�ʱ��CO32�� �����صĸ�����

 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�