��Ŀ����
����Ŀ��ij����������Ҫ����Al2O3��Al��OH��3��AlO��OH����������Fe2O3�����ʣ����ðݶ���������������������ͼ��ʾ��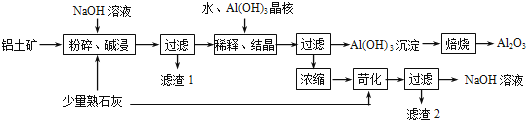
��1����������������ʱӦ�ڸ����½��У���Ŀ���� ��
��2��AlO��OH����NaOH��Ӧ�Ļ�ѧ����ʽΪ�� ��
��3����ϡ�͡��ᾧ�����У�ϡ�͵�Ŀ���� ����Al��OH��3���˵�Ŀ���Ǵٽ�Al��OH��3��������������ϡ�͡��ᾧ�����գ�Ҳ����ͨ�������� ����ķ��������森
��4��Ũ�����õ�NaOH��Һ���������˿����е�CO2���������ʣ������ʿ�ͨ��������Ӧ��ȥ��д��������Ӧ�Ļ�ѧ����ʽ���� ��
��5��������������ʵ�� ���ѧʽ����ѭ�����ã�
���𰸡��ӿ췴Ӧ�����ʣ�AlO��OH��+NaOH=NaAlO2+H2O���ٽ�NaAlO2��ˮ�⣻CO2��Na2CO3+Ca��OH��2=CaCO3��+2NaOH��NaOH
����������1����1����������������ʱӦ�ڸ����½��У��¶�Խ�߷�Ӧ�ٶ�Խ�죬���Դ��ǣ��ӿ췴Ӧ�����ʣ�
��2��AlO��OH����NaOH��Ӧ�����õ�ƫ�����ƣ��ƺ���֮��Ϊ1��1�����ԣ�AlO��OH����NaOH��1��1��Ӧ����AlO��OH��+NaOH=NaAlO2+H2O��
���Դ��ǣ�AlO��OH��+NaOH=NaAlO2+H2O��
��3��ԽϡԽˮ�⣬��ˮϡ�ʹٽ�ƫ��������ӵ�ˮ�⣬Ҳ������ƫ�������������̼���巴Ӧ�Ƶã����Դ��ǣ��ٽ�NaAlO2��ˮ�⣻CO2��
��4��Ũ�����õ�NaOH��Һ���������˿����е�CO2���������ʣ�������̼���ƣ�̼�������������Ʒ�Ӧ���ɿ����ƣ��Ӷ���ȥ̼������ӣ�����ʽΪNa2CO3+Ca��OH��2=CaCO3��+2NaOH�����Դ��ǣ�Na2CO3+Ca��OH��2=CaCO3��+2NaOH��
��5��������Ӧ�������������ƣ���ǰ���������������ܽ�����������������ʵ�ֵ�ѭ��������NaOH�����Դ��ǣ�NaOH��




