题目内容
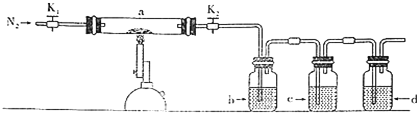
【题目】亚氯酸钠(NaClO2)主要用作棉纺、造纸业的漂白剂,也可用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:

(1)ClO2中Cl的化合价为________。
(2)从“母液”中回收的主要物质是________(填化学式)。
(3)“冷却结晶”后需________(填操作名称),该操作用到的玻璃仪器有________。
(4)反应2中转移0.1NA个电子时,生成NaClO2的质量为________g。
【答案】+4价 Na2SO4 过滤 玻璃棒、漏斗、烧杯 9.05
【解析】
由流程图可知,用稀硫酸溶解氯酸钠后,向溶液中通入二氧化硫,氯酸钠在酸性条件下与二氧化硫发生氧化还原反应生成硫酸钠和二氧化氯;二氧化氯气体与氢氧化钠和过氧化氢混合溶液发生氧化还原反应生成亚氯酸钠、氧气和水;亚氯酸钠溶液在低压55℃条件下蒸发、冷却结晶、过滤、洗涤、干燥得到粗亚氯酸钠产品。
(1)二氧化氯分子中氧元素的化合价为—2价,由化合价代数和为0可知,氯元素的化合价为+4价,故答案为:+4;
(2)由分析可知,氯酸钠在酸性条件下与二氧化硫发生氧化还原反应生成硫酸钠和二氧化氯,则母液中的主要成分为硫酸钠,故答案为:Na2SO4;
(3)冷却结晶后要分离出固体,应用过滤的方法,过滤用到的玻璃仪器为玻璃棒、漏斗、烧杯,故答案为:玻璃棒、漏斗、烧杯;
(4)二氧化氯气体与氢氧化钠和过氧化氢混合溶液发生氧化还原反应生成亚氯酸钠、氧气和水,反应的化学方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,由方程式可知生成2mol NaClO2,反应转移2mol电子,则转移0.1NA个电子时,生成NaClO2的质量为0.1mol×90.5g/mol=9.05g,故答案为:9.05。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案