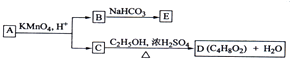
题目内容
【题目】用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.16 g O2中含有的氧分子数为NA
B.1 mol Mg变为Mg2+时失去的电子数目为2NA
C.常温常压下,11.2 L H2中含有的氢分子数为0.5NA
D.1 molL﹣1 CaCl2溶液中含有的氯离子数为NA
【答案】B
【解析】解:A、氧气的摩尔质量为32g/mol,故16g氧气的物质的量为n= ![]() =0.5mol,故含0.5NA个氧气分子,故A错误; B、镁反应后变为+2价,故1mol镁失去2mol电子即2NA个,故B正确;
=0.5mol,故含0.5NA个氧气分子,故A错误; B、镁反应后变为+2价,故1mol镁失去2mol电子即2NA个,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氢气的物质的量小于0.5mol,则氢气分子个数小于0.5NA个,故C错误;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选B.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
【题目】现有一瓶甲、乙的混合物,已知它们的性质如下表,据此,将甲、乙互相分离的最佳方法是( )
物质 | 熔点 | 沸点 | 密度 | 溶解性 |
甲 | -11.5℃ | 198℃ | 1.11 g/mL-1 | 甲、乙互溶 |
乙 | -17.9℃ | 290℃ | 1.26 g/mL-1 |
A.萃取法B.蒸馏法C.分液法D.结晶法