题目内容
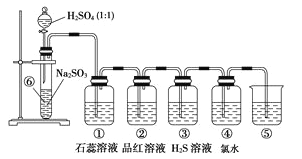
【题目】接触法制硫酸的工业生产主要分为三步:第一步,矿石燃烧的设备叫_______,其中发生的主要反应式是_______;第二步制备三氧化硫的设备是_______,发生的主要化学反应方程式是:_______;第三步用_______而不用水吸收的主要原因是_______;最后的尾气中所含污染空气的主要有害物质是_______。
【答案】沸腾炉4FeS2+11O2![]() 2Fe2O3+8SO2接触室2SO2+O2
2Fe2O3+8SO2接触室2SO2+O2![]() 2SO398.3%的浓硫酸水吸收易形成酸雾阻止三氧化硫的吸收二氧化硫
2SO398.3%的浓硫酸水吸收易形成酸雾阻止三氧化硫的吸收二氧化硫
【解析】
第一步:工业制硫酸是利用黄铁矿在沸腾炉中燃烧生成二氧化硫,然后在接触室催化氧化二氧化硫得三氧化硫,最后吸收塔用98.3%的浓硫酸吸收SO3,其中黄铁矿燃烧反应方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;第二步:接触室催化氧化,二氧化硫与空气中的氧气反应生成三氧化硫,则化学方程式为2SO2+O2
2Fe2O3+8SO2;第二步:接触室催化氧化,二氧化硫与空气中的氧气反应生成三氧化硫,则化学方程式为2SO2+O2![]() 2SO3;第三步:用98.3%的浓硫酸充分吸收SO3,为了防止形成酸雾,吸收塔中SO3如果用水吸收,发生反应SO3+H2O=H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍三氧化硫对水的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒98.3%的浓硫酸作吸收液,最终得到“发烟”硫酸,硫酸工厂排放的尾气中,含少量二氧化硫污染大气。
2SO3;第三步:用98.3%的浓硫酸充分吸收SO3,为了防止形成酸雾,吸收塔中SO3如果用水吸收,发生反应SO3+H2O=H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍三氧化硫对水的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒98.3%的浓硫酸作吸收液,最终得到“发烟”硫酸,硫酸工厂排放的尾气中,含少量二氧化硫污染大气。

练习册系列答案
相关题目