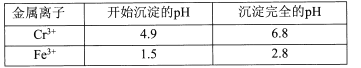
题目内容
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g) △H= Q ,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是
cC(g) +dD(g) △H= Q ,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是

A. T1 > T2 ,Q > 0
B. Tl < T2 ,Q > 0
C. P1 > P2 ,a+b=c+d
D. Pl< P2 ,b=c+d
【答案】D
【解析】
左图中,由“先拐先平数值大”知T2>T1,升高温度,生成物的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,即Q<0;
右图中,当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知P2>P1,增大压强,反应物B的含量不变,说明平衡不移动,则反应前后混合气体的分子数不变,故b=c+d(要注意A是固体)。
答案选D。

练习册系列答案
相关题目