题目内容
7.硼是第ⅢA族元素.(1)B原子的电子有3个不同的能级;晶体硼熔点为2300℃,则其为原子晶体.
(2)BF3分子为平面正三角形,则BF3属于非极性分子(填“极性”或“非极性”); 某同学列了一个比较通常化合物中离子半径大小的关系式:H->Li+>Be2+>B3+,这是个前提错误的式子,原因是非金属难以形成简单阳离子(或:通常化合物中没有B3+).
(3)原子个数相同、价电子数也相同的分子(或离子)叫“等电子体”,等电子体有相似的结构.
B3N3H6与苯是等电子体,试写出其结构式
 .
.(4)NaBH4可用于电镀(3Ni3B+Ni)为耐腐蚀的坚硬镀层.
10NiCl2+8NaBH4+17NaOH+3H2O→(3Ni3B+Ni)+5NaB(OH)4+20NaCl+□H2↑
①完成并配平以上化学方程式.
②反应中H元素化合价发生的变化是既升高又降低.
(5)B原子只有3个价电子,形成的化合物大多属于“缺电子化合物”,其中的B原子还能接受其它物质中氧(或氮等)原子的孤对电子形成“配位键”.硼酸[H3BO3或B(OH)3]是一元弱酸,它的水溶液之所以呈弱酸性并非本身电离出H+,而是硼酸与水作用时,与水电离产生的OH-结合,导致溶液中c(H+)>c(OH-).用离子方程式表示硼酸呈酸性的原因B(OH)3+H2O?H++[B(OH)4]-.
分析 (1)B的原子序数为5,核外含有的能级为1s、2s、2p;B为非金属元素,根据其熔点判断其晶体类型;
(2)分子为平面三角形结构将键的极性抵消;B为非金属元素,不存在B3+离子;
(3)B3N3H6与苯是等电子体,二者具有相似结构,根据苯的结构写出其结构式;
(4)①根据质量守恒确定未知物的化学式,然后根据H元素质量守恒确定氢气的计量数;
②NaBH4中H的化合价为-1价,8mol中总共有32个H,而氢气中总共含有34个H原子,说明还有2个H来自+1价H;
(5)硼酸与水作用,B(OH)3+H20?[B(OH)4]-+H+,导致溶液呈酸性.
解答 解:(1)B的原子序数为5,核外1s、2s、2p3个能级;B为非金属元素,晶体硼熔点为2300℃,则该晶体为原子晶体,
故答案为:3;原子;
(2)BF3分子为平面正三角形,为极性键形成的非极性分子;由于非金属难以形成简单阳离子,所以不存B3+,
故答案为:非极性;非金属难以形成简单阳离子(或:通常化合物中没有B3+);
(3)B3N3H6与苯是等电子体,苯为平面结构,苯的结构式为: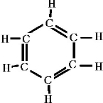 ,则B3N3H6的结构式为:
,则B3N3H6的结构式为: ,
,
故答案为: ;
;
(4)①根据反应前后O原子守恒可知,缺少的物质为H2O,再结合反应前后H元素质量守恒可知,氢气中含有35个H原子,所以氢气的计量数为:$\frac{35}{2}$=17.5,
故答案为:3H2O;17.5;
②8molNaBH4中含有32mol-1价的H原子,而17mol氢气分子中含有34molH原子,说明反应物中有2molH原子来自+1价H,则氢元素在反应中化合价既升高又降低,
故答案为:既升高又降低;
(5)硼酸与水作用时,与水电离产生的OH-结合,生成[B(OH)4]-,导致溶液中c(H+)>c(OH-),离子方程式为:B(OH)3+H2O?H++[B(OH)4]-,
故答案为:B(OH)3+H2O?H++[B(OH)4]-.
点评 本题考查了氧化还原反应的配平、电离方程式的书写、晶体类型的判断等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,(4)为难点,注意质量守恒的应用.

| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用Na2SiO3溶液制备木材防火剂 |
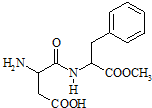 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )| A. | 分子式为C14H18N2O3,属于蛋白质 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
| A. | 金属钠着火时可用水扑灭 | |
| B. | 中秋月饼包装盒内常放入小袋生石灰作为干燥剂 | |
| C. | 铜质水龙头与铁质水管连接处容易发生电化学腐蚀导致生锈 | |
| D. | 盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性 |



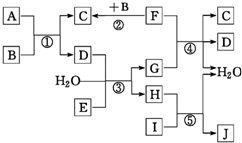 下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:
下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题: 与
与 D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷
D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题: