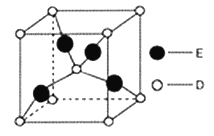
题目内容
【题目】根据反应KMnO4+FeSO4+H2SO4-MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
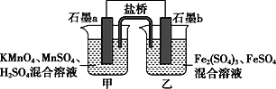
A.石墨b是原电池的负极,乙中发生氧化反应
B.电池工作时,盐桥中的K+向甲烧杯中移动
C.甲烧杯中的电极反应式:![]() +5e-+8H+=Mn2++4H2O
+5e-+8H+=Mn2++4H2O
D.忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
【答案】D
【解析】
根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。电池工作时,SO42-向负极移动,甲烧杯中的石墨电极是正极,电极反应式为MnO4-+5e-+8H+═Mn2++4H2O,乙烧杯中的电极反应式为5Fe2+-5e-═5Fe3+,溶液中的Fe2(SO4)3浓度由1molL-1变为1.5molL-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量据此回答。
A.据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,b是原电池的负极,发生氧化反应,故A正确,不符合题意;
B.电池工作时,钾离子向正极(甲烧杯)移动,盐桥的作用是形成闭合回路,保持溶液中的电荷平衡,故B正确,不符合题意;
C.甲烧杯中的石墨电极是正极,发生还原反应,电极反应式为MnO4-+5e-+8H+═Mn2++4H2O,故C正确,不符合题意;
D.溶液中的Fe2(SO4)3浓度变为1.5mol/L,由于溶液的体积未变,则反应过程中生成的铁离子的物质的量为0.2mol,转移的电子为0.2mol,故D错误,符合题意。
答案选D。

【题目】化学反应条件是研究化学反应的重要方向。
(1)化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g)+H2(g) △H=+139kJ·mol-1
C4H8(g)+H2(g) △H=+139kJ·mol-1
一定条件下,以异丁烷为原料生产异丁烯,在202kPa和808kPa下异丁烷平衡转化率随温度的变化如图所示。
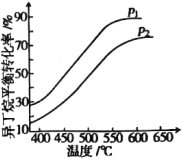
①p1=_______kPa,选择异丁烯制备的温度条件是550~600℃的理由是_________________。
②若平衡混合气中异丁烯的体积分数为25%,则异丁烷的平衡转化率为_______%(保留小数点后1位)。
(2)异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-0为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以r-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26. 17 | 27. 11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a 载体会影响催化剂的活性 b 载体会影响催化剂的选择性 c 载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:__________。
(3)工业上用复合氧化钴(组成为Co3O4)、碳酸锂以Li/Co(原子比)=1混合,在空气中900℃下加热5小时制备锂离子电池正极材料LiCo O2,写出制备LiCoO2的化学方程式__________。废旧的锂离子电池需要回收,“放电处理”废旧的锂离子电池有利于锂在正极回收的原因是____________。