题目内容
【题目】工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝.
(1)有一种用CO2生产甲醇燃料的方法:CO2+3H2CH3OH+H2O 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
CH3OH(g)═CH3OH(l)△H=﹣c kJmol﹣1;
则表示CH3OH(l)燃烧热的热化学方程式为: .
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)制备.图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题: 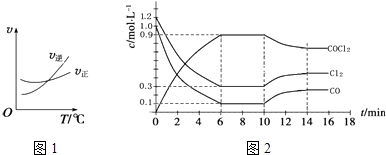
①0~6min内,反应的平均速率v(Cl2)=;
②10min改变的条件是 , 该反应平衡常数变化的趋势是(填“增大”、“减小”或“不变”).
(3)利用氨水可以将SO2和NO2吸收,原理如图3所示:NO2被吸收的离子方程式是 . 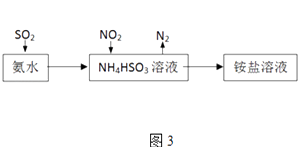
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如图4,判断B为电源的极,电解时阳极的电极反应式为 . 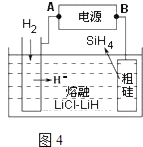
【答案】
(1)CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJ?mol﹣1
b+2c﹣a﹣d)kJ?mol﹣1
(2)0.15mol?L﹣1?min﹣1;升高温度;减小
(3)2NO2+4HSO3﹣═N2+4SO42﹣+4H+
(4)正;Si+4H﹣﹣4e﹣═SiH4↑
【解析】解:(1)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣a kJmol﹣1; ②2H2(g)+O2(g)═2H2O(g)△H=﹣b kJmol﹣1;
③H2O(g)═H2O(l)△H=﹣c kJmol﹣1;
④CH3OH(g)═CH3OH(l)△H=﹣d kJmol﹣1 ,
由盖斯定律可知,②× ![]() +③×2﹣①﹣④得到CH3OH(l)+
+③×2﹣①﹣④得到CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1 ,
b+2c﹣a﹣d)kJmol﹣1 ,
则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2(l)△H=﹣(
O2(g)=CO2(g)+2H2(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1 ,
b+2c﹣a﹣d)kJmol﹣1 ,
所以答案是:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1;(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L﹣0.3mol/L=0.9mol/L,则v(Cl2)=
b+2c﹣a﹣d)kJmol﹣1;(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L﹣0.3mol/L=0.9mol/L,则v(Cl2)= ![]() =0.15 molL﹣1min ﹣1 ,
=0.15 molL﹣1min ﹣1 ,
所以答案是:0.15 molL﹣1min﹣1 ;
②影响平衡移动的因素有温度、浓度和压强,该反应是放热反应,由图可知,第10 min时平衡逆向移动,只能是升温,由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,
所以答案是:升高温度;减小;(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3﹣=N2+4SO42﹣+4H+;
所以答案是:2NO2+4HSO3﹣═N2+4SO42﹣+4H+;(4)从图示知,粗硅变化为SiH4 , 失电子发生氧化反应,B为电源的正极,H﹣移向阳极生成SiH4 , 电极反应式为Si+4H﹣﹣4e﹣=SiH4↑,
所以答案是:正; Si+4H﹣﹣4e﹣═SiH4↑;
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案