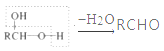题目内容
【题目】由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫酸,发生反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. Na4S2O3的水溶液显碱性
B.1mol Na4S2O3中共含离子数为5NA
C.上述反应中,每产生3molS,转移电子的物质的量为6mol
D.CaOCl2也可称为混盐,向CaOCl2中加入足量稀硫酸会有Cl2产生
【答案】AD
【解析】
混盐Na4S2O3中S元素的平均化合价为+1价,应为Na2SO3和Na2S的混盐,混盐CaOCl2中相当于含有CaCl2和Ca(ClO)2两种盐。
A.由分析可知Na4S2O3为Na2SO3和Na2S的混盐,Na2SO3和Na2S都是强碱弱酸盐,溶液呈碱性,A正确;
B.由分析可知Na4S2O3为Na2SO3和Na2S的混盐,所以1molNa4S2O3中共含离子数为2+1+2+1=6NA,B错误;
C.由![]() 可知,生成单质硫的S元素化合价由+1变为0,则每产生3molS,转移电子的物质的量为3mol,C错误;
可知,生成单质硫的S元素化合价由+1变为0,则每产生3molS,转移电子的物质的量为3mol,C错误;
D.在酸性条件下,发生反应:Cl-+ClO-+2H+=Cl2↑+H2O,即向CaOCl2中加入足量稀硫酸会有Cl2产生,D正确;
答案选AD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | I3—溶液中存在平衡: I3— |
B | 在Ca(ClO)2溶液中通入SO2气体,有沉淀生成 | 酸性:H2SO3>HClO |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 | 植物油含有酯基 |
A.AB.BC.CD.D