题目内容
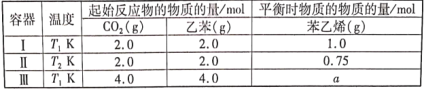
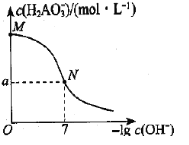
【题目】已知:H3AO3与足量NaOH溶液反应生成NaH2AO3,25℃时,K(H3AO3)=9.7×10-11。常温下,用0.100mol/L盐酸滴定20.00mL0.100mol/L NaH2AO3溶液。溶液中c(![]() )与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
)与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
A.H3AO3为三元酸
B.溶液中水电离程度为:M<N
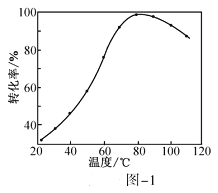
C.a>0.05
D.M到N过程中,溶液中存在c(Na+)=c(![]() )+c(H3AO3)
)+c(H3AO3)
【答案】D
【解析】
A.由“H3AO3与足量NaOH溶液反应生成NaH2AO3”知,NaH2AO3为正盐,H3AO3为一元酸,A不正确;
B.在M点,![]() 在溶液中发生水解,促进水的电离,而在N点时溶液中有H3AO3,抑制水的电离,所以水电离程度为:M>N,B不正确;
在溶液中发生水解,促进水的电离,而在N点时溶液中有H3AO3,抑制水的电离,所以水电离程度为:M>N,B不正确;
C.在N点时,-lgc(OH-)=7,此时c(H+)=10-7mol/L,K(H3AO3)=![]() = 9.7×10-11,从而得出
= 9.7×10-11,从而得出![]() = 9.7×10-4,此时溶液中c(
= 9.7×10-4,此时溶液中c(![]() )<c(H3AO3),a<0.05,C不正确;
)<c(H3AO3),a<0.05,C不正确;
D.M到N过程中,![]() +H+=H3AO3,此时c(
+H+=H3AO3,此时c(![]() )+c(H3AO3)不变,依据物料守恒原理,溶液中存在c(Na+)=c(
)+c(H3AO3)不变,依据物料守恒原理,溶液中存在c(Na+)=c(![]() )+c(H3AO3),D正确;
)+c(H3AO3),D正确;
故选D。

练习册系列答案
相关题目