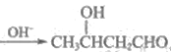题目内容
【题目】I.下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中元素I的价层电子排布图 。元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有( )
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)的配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
Ⅱ.(1) BCl3中B原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有 种。写出与BCl3结构相同的一种等电子体 (写离子)。
(2)科学家测得胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
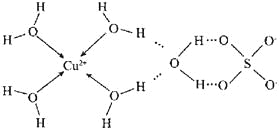
①胆矾的化学式用配合物的形式表示为的 ;
②胆矾中SO42-的空间构型为 。
【答案】I(1)![]() ;F>N>O>C (2)CD (3)BDF
;F>N>O>C (2)CD (3)BDF
(3)根据其性质可知应为分子晶体,晶体中存在范德华力,Cr(CO)5为配位化合物,其中含有配位键,CO中存在碳氧极性键。
Ⅱ.(1) sp23 NO3-或CO3 2-(2) ①[Cu(H2O)4SO4]·H2O ②正四面体
【解析】试题分析:根据元素在周期表中的位置知,从A~J分别是H、Be、C、N、O、F、Al、Cl、Cr、Fe元素;
(1)元素Cr的价层电子排布式为3d54s1,排布图如![]() ;同周期随核电荷数递增,第一电离能呈增大趋势,但因N原子的2p3轨道为半充满结构,相对稳定,元素C、N、O、F的第一电离能由大到小的顺序是F>N>O>C;
;同周期随核电荷数递增,第一电离能呈增大趋势,但因N原子的2p3轨道为半充满结构,相对稳定,元素C、N、O、F的第一电离能由大到小的顺序是F>N>O>C;
(2)元素H分别与C、N、O形成最简单的常见化合物分子CH4、NH3和H2O;A.CH4、NH3和H2O分子的空间构型分别为正四面体形、三角锥形、V形,故A正确;B.CH4、NH3和H2O分子中,中心原子均采取sp3的杂化方式,故B正确;C.CH4、NH3和H2O三种分子中键角由大到小的顺序是甲>乙>丙,故C错误;D.NH3和H2O分子均为由极性键构成的极性分子,CH4为极性键构成的非极性分子,故D错误;答案为CD。
(3)配位化合物为Fe(CO)5,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体,分子之间存在范德华力,Fe与CO之间形成配位键,CO分子中含有极性键,故选BDF;
Ⅱ.(1)BCl3中的B原子的价层电子对数是3且不含孤电子对,所以B原子属于sp2杂化;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;BCl3互为等电子体的阴离子为:NO3-或CO3 2-;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子,所以其表示式为[Cu(H2O)4]SO4.H2O;
②胆矾中SO42-的价层电子对个数=4+×(6+2-4×2)=4,所以其空间构型正四面体结构。