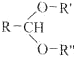
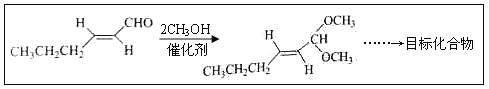
题目内容
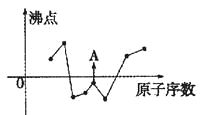
【题目】(1)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
(2)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(3)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)很多金属盐都可以发生焰色反应,其原因是
(5) 已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.
【答案】(1)F2 (2)X射线衍射 (3)16 (4)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来 (5)在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键
【解析】试题分析:(1)图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,A以及前面的2种单质的沸点都低于0℃,则连续3种均为气体单质,在周期表中,连续出现气体单质的为第二周期的N、O、F,所以A为第三种气体单质,则为F2;
(2)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定;
(3)该晶胞中O原子数为4×1+6×+8×=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
(4)很多金属盐都可以发生焰色反应是因为激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量;
(5)在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键。