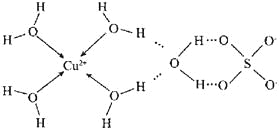
题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
【答案】(1)1s22s22p63s1或[Ne]3s1,Cl;
(2)H2O分子间存在氢键,而H2S分子间没有氢键;
(3)平面三角形;(4)Na+;
(5)3H2O2+K2Cr2O7+4H2SO4=K2SO4+Cr2(SO4)3+3O2↑+7H2O。
【解析】试题分析:M元素的2p电子数是2s的2倍,故价电子排布应为2s22p4,M为氧元素。R的原子序数比氧大,又是短周期金属,故只能是第三周期。第三周期最活泼的金属是钠。X与M的化合物,引起酸雨,只有可能是二氧化硫或氮氧化物。但是X的原子序数比氧大,故X只能是硫元素。Y的原子序数比X大,又是短周期元素,只能是氯元素。Z的最高价含氧酸的钾盐是橙色,这是重铬酸盐的典型颜色。题目中关于4s、3d轨道半充满的描述,也能推出Z是铬元素(3d54s1),(1)R为Na,属于第三周期IA族,电子排布式为1s22s22p63s1或[Ne]3s1,同周期从左向右电负性增强,即电负性Cl>S;(2)X的氢化物为H2S,M的氢化物是H2O,H2O分子之间存在氢键,H2S分子间不存在分子间氢键,存在分子间氢键的物质,熔沸点高;(3)此分子为SO3,有3个σ键,孤电子对数为(6-2×3)/2=0,空间构型为平面三角形;(4)白球占有顶点和面心,因此白球的个数为8×1/8+6×1/2=4,黑球位于体心,有8个,因此个数比为1:2,此物质的分子式为Na2O,因此黑球是Na+,白球是O2-;(5)Z的最高价含氧酸的钾盐是K2Cr2O7,O的氢化物为H2O、H2O2,重铬酸钾只能氧化H2O2,因此反应方程式为:3H2O2+K2Cr2O7+4H2SO4=K2SO4+Cr2(SO4)3+3O2↑+7H2O。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸。反应方程式如下:
![]() +2KMnO4
+2KMnO4![]()
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
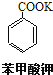
![]() +HCl→
+HCl→![]() +KCl
+KCl
已知有关化合物的相关数据如表所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
苯甲酸钾 | 160 | — | 易溶于水 | — |
苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
苯甲酸在100g水中的溶解度0.18g(4℃),0.27g(18℃),2.2g(75℃)。
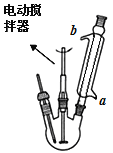
合成:如上图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾。经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物。
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④_________→⑤过滤→⑥洗涤→⑦干燥。
请回答下列问题:
(1)实验室中量取4.23mL甲苯所需仪器为_________。
(2)冷凝管的上口是否需要塞上塞子________(填“是”或“否”),a处水流方向是_______(填“进水”或“出水”)。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由_________。
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是_________;“④”的操作名称是________;可证明“⑥洗涤”步骤已洗涤干净的方法是_____________。
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为________。