题目内容
10.培养明矾晶体,为使晶体颗粒结得大一些,不应采取的方法是( )| A. | 用比室温约高10~20℃的水溶解明矾晶体得到饱和溶液 | |
| B. | 使明矾饱和溶液急速冷却 | |
| C. | 选用形状较为规则的小明矾晶体作晶核 | |
| D. | 结晶过程中,应将硬纸板盖住盛有饱和溶液的烧杯 |
分析 培养明矾晶体的成败关键是:1.所用试剂必须纯净,如含有杂质就很难获得完整的晶形.2.控制溶液的浓度,如果溶液过浓,析晶速率太快,不易形成晶形完整的晶体;3.如超过饱和溶液浓度不大,结晶速率太慢,小晶体慢慢长大.3.注意环境温度的变化,应使饱和溶液缓慢冷却.4.所用容器必须洁净,要加盖以防灰尘落入,据此进行判断.
解答 解:A.温度降低的时候,饱和度也会降低,明矾会吸附在小晶核上,所以要得到较大颗粒的明矾晶体,配制比室温高10~20℃明矾饱和溶液,故A正确;
B.应该使饱和溶液的温度缓慢降低,否则析晶速率太快,不易形成晶形完整的晶体,故B错误;
C.选用形状较为规则的小明矾晶体作晶核,更有利于晶体的析出,故C正确;
D.实验过程中,所用容器必须洁净,要将硬纸板盖住盛有饱和溶液的烧杯,防止灰尘落入,故D正确;
故选B.
点评 本题考查了明矾晶体的制备方法,题目难度不大,该题基础性较强、贴近生活实际,有利于调动学生的学习兴趣,激发学生的学习积极性,提高学生的学习效率.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
20.只用一种试剂,区别甲苯、己烯、四氯化碳、乙醇溶液,可选用的试剂是( )
| A. | 硝酸银溶液 | B. | 溴水 | C. | 澄清石灰水 | D. | 酸性高锰酸钾 |
18. 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 大理石 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
5.已知Ksp(BaSO4 )=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法中不正确的是( )
| A. | BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=4.4×10-2 | |
| D. | 常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol•L-1 |
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.2g O2混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,则消耗溶液中NaOH的质量是( )
| A. | 16g | B. | 32g | C. | 64g | D. | 无法计算 |
2.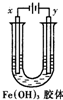 如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
 如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )| A. | x是阳极,y是阴极 | B. | x极附近颜色变深,y极近颜色变浅 | ||
| C. | x是阴极,y极附近颜色加深 | D. | y是阴极,x极附近颜色加深 |
19.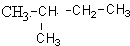 的命名正确的是( )
的命名正确的是( )
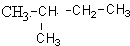 的命名正确的是( )
的命名正确的是( )| A. | 3-甲基丁烷 | B. | 2-甲基戊烷 | C. | 2-甲基丁烷 | D. | 1,1-二甲基丙烷 |
20.石油化工专家闵恩泽院士获2007年度国家最高科学技术奖.他是石油化工技术自主创新的先行者和绿色化学的开拓者,他研制的多种石油炼制催化剂极大地降低了我国石油化工产品的成本.下列说法中正确的是( )
| A. | 硫酸的产量是衡量一个国家石油化工水平发展的标志 | |
| B. | 石油裂化的主要目的是为了获得短链的不饱和烃 | |
| C. | 臭氧空洞的形成与化石燃料煤、石油的大量使用无关 | |
| D. | 石油的主要成分是碳氢化合物 |
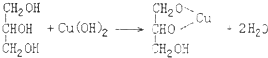 .
. +HCO3-→
+HCO3-→ +H2O+CO2↑.
+H2O+CO2↑.