题目内容
I.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.
回答下列问题:
(1)Y元素在元素周期表中的位置是 .
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: .
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) .
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为 .
II.已知可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数见下表:
(5)该反应△H 0(填“<”或“>”).
(6)850℃时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件
是 .若x=5.0,当反应达到平衡时,n(H2)= .
回答下列问题:
| X | ||
| Y | Z |
(2)列举一个事实证明Y元素与Z元素的非金属性强弱:
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为
II.已知可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数见下表:
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(6)850℃时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件
是
分析:I.短周期元素X、Y、Z,由元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期,Y元素原子的最外层电子数是电子层数的两倍,Y原子最外层电子数为6,故Y为S,由位置关系可知推知X为N、Z为Cl,
(1)主族元素,周期数=电子层数、主族族序数=最外层电子数;
(2)根据最高价含氧酸的酸性、氢化物稳定性等验证非金属性强弱;
(3)N元素的气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,其溶液中NH4+离子水解,破坏水的电离平衡,溶液呈酸性;
(4)N元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,则该氢化物为N2H4,该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,该气体为N2,根据元素守恒可知还有水生成;
II.(5)根据温度对平衡常数的影响分析解答;
(6)表示出算浓度商Qc,平衡向正反应进行,则Qc<K,据此列不等式计算x的取值范围;
若x=5.0,计算浓度商判断反应进行方向,设平衡时参加反应氢气的物质的量为a,利用三段式表示出平衡时各组分的物质的量,再根据平衡常数列方程计算.
(1)主族元素,周期数=电子层数、主族族序数=最外层电子数;
(2)根据最高价含氧酸的酸性、氢化物稳定性等验证非金属性强弱;
(3)N元素的气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,其溶液中NH4+离子水解,破坏水的电离平衡,溶液呈酸性;
(4)N元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,则该氢化物为N2H4,该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,该气体为N2,根据元素守恒可知还有水生成;
II.(5)根据温度对平衡常数的影响分析解答;
(6)表示出算浓度商Qc,平衡向正反应进行,则Qc<K,据此列不等式计算x的取值范围;
若x=5.0,计算浓度商判断反应进行方向,设平衡时参加反应氢气的物质的量为a,利用三段式表示出平衡时各组分的物质的量,再根据平衡常数列方程计算.
解答:解:I.短周期元素X、Y、Z,由元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期,Y元素原子的最外层电子数是电子层数的两倍,Y原子最外层电子数为6,故Y为S,由位置关系可知推知X为N、Z为Cl,
(1)由上述分析可知Y为S,原子有3个电子层、最外层电子数为6,处于第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)酸性:HClO4>H2SO4或稳定性:HCl>H2S等,可以说明非金属性Cl>S,
故答案为:酸性:HClO4>H2SO4或稳定性:HCl>H2S;
(3)N元素的气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,其溶液中NH4+离子水解NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,即pH<7,
故答案为:<;NH4++H2O?NH3?H2O+H+;
(4)N元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,则该氢化物为N2H4,该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,该气体为N2,根据元素守恒可知还有水生成,该反应方程式为:N2H4+4CuO=N2↑+2Cu2O+2H2O,
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O;
II.(5)由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即△H<0,
故答案为:<;
(6)该反应气体气体体积不变,可以用物质的量代替浓度表示平衡常数,故浓度商Qc=
,由于平衡向正反应进行,则Qc<K,即
<1,解得x<3,
若x=5.0,则Qc=
=1.67>1,故反应向逆反应进行,令平衡时氢气的物质的量为a,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):1 3 1 5
变化(mol):a a a a
平衡(mol):1+a 3+a 1-a 5-a
则
=1,解得a=0.2
故平衡时氢气的物质的量为5mol-0.2mol=4.8mol,
故答案为:x<3;4.8mol.
(1)由上述分析可知Y为S,原子有3个电子层、最外层电子数为6,处于第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)酸性:HClO4>H2SO4或稳定性:HCl>H2S等,可以说明非金属性Cl>S,
故答案为:酸性:HClO4>H2SO4或稳定性:HCl>H2S;
(3)N元素的气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,其溶液中NH4+离子水解NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,即pH<7,
故答案为:<;NH4++H2O?NH3?H2O+H+;
(4)N元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,则该氢化物为N2H4,该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,该气体为N2,根据元素守恒可知还有水生成,该反应方程式为:N2H4+4CuO=N2↑+2Cu2O+2H2O,
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O;
II.(5)由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即△H<0,
故答案为:<;
(6)该反应气体气体体积不变,可以用物质的量代替浓度表示平衡常数,故浓度商Qc=
| 1×x |
| 1×3 |
| 1×x |
| 1×3 |
若x=5.0,则Qc=
| 1×5 |
| 1×3 |
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):1 3 1 5
变化(mol):a a a a
平衡(mol):1+a 3+a 1-a 5-a
则
| (1-a)×(5-a) |
| (1+a)×(3+a) |
故平衡时氢气的物质的量为5mol-0.2mol=4.8mol,
故答案为:x<3;4.8mol.
点评:本题属于拼合型题目,涉及位置结构性质关系应用、化学平衡常数的影响因素与有关计算,难度中等,注意掌握平衡常数的应用.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目




 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑




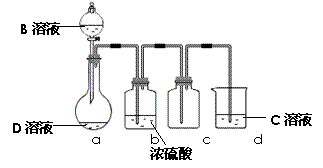 (3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。