题目内容
【题目】(1)已知用含硫酸铁的废液(含少量杂质)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:
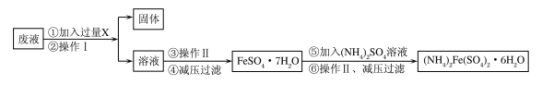
回答下列问题:
①试剂X是_______,操作Ⅰ的名称为:____。
②减压过滤的目的是:____。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定,测得消耗KMnO4溶液的平均体积为23.00mL。滴定终点的现象为:_____________________________;该晶体中铁的质量分数为___________。(保留4位有效数字)
(2)某课题组通过实验检验摩尔盐晶体加热时的分解产物。
①摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、SO2、NH3、H2O
c.FeO、NH3、SO3、H2O d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想___________不成立(填序号)。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______C装置中红色褪去,说明气体产物中含有__________。
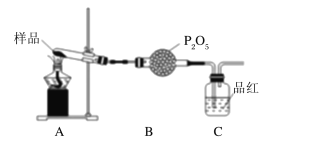
③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B、C中的试剂即可,则更换后的试剂为B中______________、C中酚酞溶液。
【答案】Fe; 过滤; 降低沸点,减少能量损耗; 滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色。 12.88%; ab; Fe2O3; SO3; 碱石灰。
【解析】
硫酸铁与铁反应生成硫酸亚铁,过滤后分离滤液和滤渣,为得到七水硫酸亚铁晶体需要蒸发浓缩、冷却结晶。减压过滤的目的是降低沸点,减少能量损耗。滴定过程中,由于是用逐滴酸性KMnO4滴定Fe2+的浓度,则终点的现象为滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色。
(1) ①试剂X是Fe,操作Ⅰ的名称为过滤;
②减压过滤的目的为降低沸点,减少能量损耗;
③滴定过程中,由于是用逐滴酸性KMnO4滴定Fe2+的浓度,则终点的现象为滴入最后一滴酸性KMnO4溶液,溶液颜色由无色变为浅红色,且半分钟内部变色;
根据方程式中转移电子守恒,5Fe2+ ~ KMnO4,则250mL溶液中n(Fe2+)=5n(KMnO4)=5×0.023L×0.01mol/L×10=0.0115mol;质量为0.644g;则质量分数为12.88%;
(2) ①摩尔盐受热分解,可能会发生氧化还原反应,
a.Fe2O3、SO3、NH3、H2O 中只有Fe的化合价升高,没有化合价降低,所以a不成立;b.FeO、SO2、NH3、H2O中只有S的化合价降低,没有化合价升高,所以b不成立;
c.FeO、NH3、SO3、H2O中没有化合价变化,c成立;
d.Fe2O3、NH3、SO2、SO3、H2O中化合价的升高和降低,d成立
综上,猜想ab不成立;
②题意中固体呈红棕色,则产物中含有Fe2O3,C装置中品红褪色,说明气体产物中含有SO2;
③证明分解产物中含有氨气,B应该除去SO2,所以B中试剂为碱石灰; C中酚酞溶液检验NH3。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
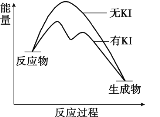
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性