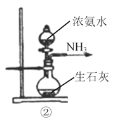
题目内容
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
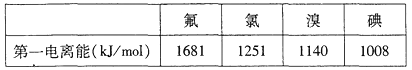
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

【答案】1s22s22p63s23p63d8 d sp3 Ⅰ 三角锥 SO32- 是 是 正八面体 5.2
【解析】
(1)Ni2+基态原子的核外电子排布为1s22s22p63s23p63d8,铬元素在周期表中d区。
(2)聚硅氧烷中C形成4个单键;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP,等电子体是指原子总数相同,价电子总数也相同的微粒;
(4)根据O2-的坐标分析,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,根据密度公式ρ=m/V计算。
(1)Ni2+基态原子的核外电子排布为1s22s22p63s23p63d8,铬元素在周期表中d区。
(2)聚硅氧烷中C形成4个单键,所以C的杂化方式为sp3;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子,所以有可能生成较稳定的单核阳离子的卤素原子是:I;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP=3+(7-2×3+1)/2=4,VSEPR模型为四面体形,由于一对孤电子对占据四面体的一个顶点,所以其空间构型为三角锥形,
等电子体是指原子总数相同,价电子总数也相同的微粒,则与ClO3-互为等电子体的是SO32-;
(4)晶胞中,O2-的坐标为(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2),将(1/2,1/2,1/2)+(1/2,1/2,0)=(0,0,1/2),将(1/2,1/2,1/2)+(0,1/2,1/2)=(1/2,0,0),将(1/2,1/2,1/2)+(1/2,0,1/2)=(0,1/2,0),刚好与前三个坐标相同,所以O2-做面心立方最密堆积,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,以立方体计算,1个立方体中含有Fe3+的个数为4×1/8+1/2×3=2个,含有Fe2+的个数为1个,含有O2-的个数为12×1/4+1=4个,不妨取1mol这样的立方体,即有NA个这样的立方体,1mol立方体的质量为m=(56×3+16×4)g,1个立方体体积为V=a3nm3=a3(a×10-7)3cm3,则晶体密度为ρ=m/NAV=(56×3+16×4)/(6.02×1023)×(0.42×10-7)3g·cm-3=5.2g·cm-3。

【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃