题目内容
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
(本题共12分)(1)过滤(1分);通入足量的Cl2(1分) BaCl2(1分)、K2CO3(1分);取样,滴加KSCN溶液,无明显现象(1分);
(2)NH3、CO2(共1分)NH3 + CO2 + H2O → NH4HCO3↓(1分)
KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出(1分)
(3)阴(1分);阴(1分) (4)4NO2 + O2 + 2H2O → 4HNO3(1分)能耗低(节能)(1分)
解析试题分析:(1)当沉淀完全后,需要通过过滤分离出沉淀;溴离子具有还原性,又因为不能引入新的杂质,所以可以通入足量氯气除去溴离子;氨水除去铁离子,SO42-应该有Ba2+除去,过量的Ba2+用碳酸钾除去,过滤后加入盐酸酸化即可除去过量的碳酸钾;铁离子检验一般用KSCN溶液,所以证明Fe3+已沉淀完全的操作是取样,滴加KSCN溶液,无明显现象。
(2)根据侯氏制碱法原理可知,应该向饱和KCl溶液中依次通入足量的氨气后CO2。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊,这说明该晶体一定不是碳酸氢钾,而是碳酸氢铵,因此生成碳酸氢铵的化学方程式是NH3+CO2+H2O→NH4HCO3↓。由于KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出,因此得不到碳酸氢钾,故而也得不到碳酸钾。
(3)惰性电极电解氯化钾溶液时,氯离子在阳极放电,生成氯气。阴极是氢离子放电生成氢气,同时破坏了阴极周围水的电离平衡,所以氢氧化钾在阴极区产生。由于阳极生成的氯气能和氢氧化钾反应生成氯化钾、次氯酸钾和水,所以要防止该副反应发生,应该阻止OH-向阳极移动,所以位于电解槽中间的离子交换膜应阻止阴离子通过。
(4)根据已知反应2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O、4KNO3 + 2H2O → 4KOH + 4NO2 + O2阳极总反应式4KCl + O2 + 2H2O → 4KOH + 2Cl2可知,硝酸和NO2是多余的,因此第⑤步反应应该是NO2生成硝酸的化合反应,即4NO2 + O2 + 2H2O → 4HNO3。因此与电解法相比,该方法的优势可能是能耗低(节能)。
考点:考查物质的分离与提纯;铁离子检验;侯氏制碱法;电解原理应用以及实验方案设计与评价等

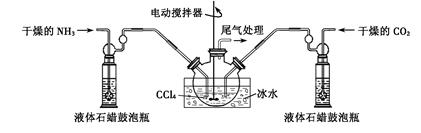
TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
| 选用的仪器 | 加入试剂 | 加入试剂的作用 |
| C | H2O2溶液与MnO2 | 产生氧气 |
| | | |
| | | |
| D | CuO粉末 | 将可能生成的CO转化为CO2 |
| | | |
| | | |
| | | |
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。
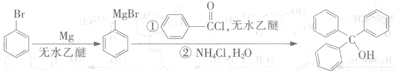
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):

回答下列问题:
(1)装置B、C中玻璃容器的名称: ;反应原理(填写数字序号): 。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是 。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中 实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是 。
(5)A部分仪器装配时,放好铁架台后,应先固定 (填仪器名称),整套装置装配完毕后,应先进行 再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是 。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是: (用离子方程式表示)。
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
  温度℃ 温度℃溶解度 溶质 g/100g水 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | | | | |
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a 、 b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含有NaHCO3 。
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。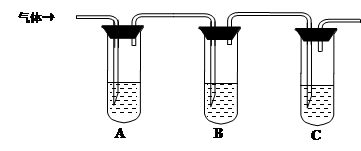
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
下列有关实验装置进行的相应实验,能达到实验目的的是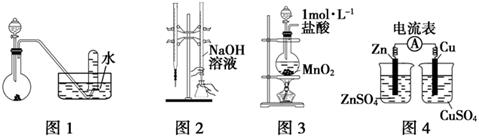
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |


 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 )