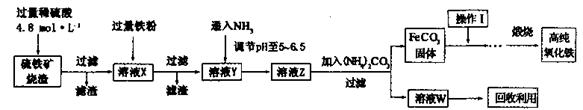
题目内容
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
  温度℃ 温度℃溶解度 溶质 g/100g水 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | | | | |
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a 、 b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含有NaHCO3 。
(1)Ca2+、Mg2+(2分,各1分)
(2)Na+ + HCO3- →NaHCO3↓(1分)
(3)水浴加热(1分)温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小(2分)
(4)过滤 洗涤(2分)
(5)①Na2CO3%= (2分)[M(Na2CO3)用106表示也得分]
(2分)[M(Na2CO3)用106表示也得分]
②黄色变为橙色且半分钟不变(1分);V2>V1则含有NaHCO3(1分)
解析试题分析:(1)足量NaOH可以除去Mg2+;Na2CO3溶液可以除去Ca2+,故答案为:Ca2+、Mg2+;
(2)NH4HCO3与NaCl反应:NH4HCO3与+NaCl=NaHCO3↓+NH4Cl,离子方程式Na++HCO3-=NaHCO3↓,故答案为:Na++HCO3-=NaHCO3↓;
(3)根据水浴加热温度易控制且受热均匀;温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小;故答案为:水浴加热;温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小;
(4)NH4HCO3与氯化钠两者发生反应生成碳酸氢钠,便有晶体析出,然后过滤、洗涤可得NaHCO3晶体,故答案为:过滤;洗涤;
(5)①酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色,指示CO32-+H+=HCO3-反应的终点,所用HCl溶液体积为V1mL,碳酸氢钠的质量为c×V1×10-3×M(Na2CO3)g,碳酸钠的质量分数为c×V1 ×10?3×M(Na2CO3)g Gg
②用甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,指示HCO3-+H+=CO2+H2O反应的终点,所用HCl溶液体积为V2 mL,若V2=V1,只有Na2CO3;若V2>V1,则含有NaHCO3,故答案为:黄色变为橙色且半分钟不变;V2>V1则含有NaHCO3.
考点:本题主要考查侯氏制碱法的原理和过程,同使也考查了双指示剂法,难度稍大.

某实验小组对普通锌锰废干电池内的黑色固体进行探究,设计如下方案:
己知:I、普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。
II、氢氧化锌为白色粉末,不溶于水,溶于酸、强碱溶液和氨水。
请回答以下问题:
(1)②操作的名称是___________。
(2)某同学猜想溶液A的成分含有NH4Cl和ZnCl2,请你设计一个实验方案,验证其猜想正确,要求在答题卡上按下表格式写出实验操作、预期现象和结论。
限选试剂:蒸馏水、2moL·L-1 HCI 、2 moL·L-1 HNO3 、2 moL·L-1 NH3·H2O、6 moL·L-1 NaOH、0.1 moL·L-1 KSCN、0.1 moL·L-1 BaCl2、0.1 moL·L-1 AgNO3、紫色石蕊试液、红色石蕊试纸
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__ __________________________ | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管,__________ __________________________ | ______________________ | _______________________ |
| 步骤3:往c试管,__________ __________________________ | 先产生_______________, 后____________________ | 说明溶液A含有Zn2+ |
(3)取少量固体c放入试管,滴加入双氧水,观察到有气体产生,写出该反应的化学方程式:_______________。
(4)为测定废干电池中二氧化锰的质量分数,进行下面实验:准确称取ag废千电池固体,溶于稀硫酸,加入碘化钾溶液,充分反应后,用bmol/L硫代硫酸钠标准溶液滴定,用淀粉作指示剂,滴定至终点,重复实验,平均消耗硫代硫酸钠标准溶液的体积为vmL,则废电池中二氧化锰的质量分数的计算表达式为:________________________________。
(滴定有关反应:MnO2+2I-+4H+=Mn2++I2+2H2O;I2+2S2O32-=2I-+S4O62-)
发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成;
假设2:由小苏打和明矾组成;
假设3:由________________组成。
【方案与流程】
为探究某品牌的发酵粉的化学成分,某同学设计如下实验,得到如下现象:
(2)该发酵粉的成分为________ (填化学式)。
(3)另一品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证,写出实验步骤、预期现象和结论。
| 实验步骤 |  预期现象结论 预期现象结论 |
| 1.取少量样品溶于稀盐酸后,将溶液分成两份 | |
| 2. _______________________________________ | |
| 3. ________________________________________ | |
(4)另一品牌的发酵粉的化学组成为小苏打和碳酸氢铵,为探究其化学式[化学式可表示为nNaHCO3·m NH4HCO3],称取4.05 g该产品在烧杯中溶解后,移入________配成100 mL溶液,用移液管取25.00mL溶液,滴加足量盐酸,生成的气体通入过量澄清石灰水中,生成的白色沉淀经干燥,称量为1.25 g。则该发酵粉的化学式为 。
(相对分子质量:NaHCO3:84 NH4HCO3:79 CaCO3:100)
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )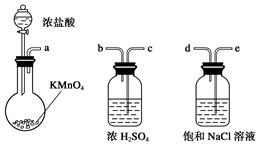
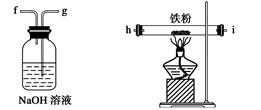
| A.a-b-c-d-e-e-f-g-h |
| B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g |
| D.a-c-b-d-e-h-i-f |