题目内容
【题目】下图是元素周期表的一部分,用化学用语回答下列问题:

(1)元素Fe在周期表中的位置为________。
(2)⑦与⑧形成的化合物中各原子均满足8电子稳定结构的是_____。(用化学式表示)
(3)④、⑦、⑧三种元素的非金属性由强到弱的顺序是________。(用元素符号表示)
(4)用电子式表示含元素⑥的10电子二元化合物的形成过程________。
(5)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________ 。
【答案】第四周期第Ⅷ族 PCl3 Cl>P>C ![]() 5NaClO+2As+3H2O=2H3AsO4+5NaCl
5NaClO+2As+3H2O=2H3AsO4+5NaCl
【解析】
由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为N,⑥为O,⑦为P,⑧为Cl,然后结合化学用语及原子结构特点、元素化合物的知识来解答。
(1)Fe元素为26号元素,位于第四周期第Ⅷ族;
(2)⑦为P,⑧为Cl,两种元素形成的化合物中各原子均满足8电子稳定结构的是PCl3;
(3)④为C,⑦为P,⑧为Cl,最高价氧化对应的水化物的酸性越强,非金属越强,HClO4为强酸,H3PO4为中强酸,H2CO3为弱酸,所以三种元素的非金属性由强到弱的顺序是Cl>P>C;
(4)⑥为O,含氧元素的10电子二元化合物为H2O,其形成过程可以表示为:![]() ;
;
(5)②为Na,⑥为O,⑧为Cl,三种元素组成的Y为常见消毒剂,应为NaClO,与As的反应生成As的最高价含氧酸,即H3AsO4,根据元素守恒和电子守恒可得化学方程式为5NaClO+2As+3H2O=2H3AsO4+5NaCl。

 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____。
(4)25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______。
A. B.
B.
C.  D.
D.
(5)能证明醋酸是弱酸的实验事实是______(填写序号)。
① 相同条件下,浓度均为0.1 molL-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1molL-1 CH3COOH溶液可使紫色石蕊试液变红
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
【题目】某课外活动小组的同学在实验室用如下装置制取乙酸乙酯。其主要步骤如下:
①在30mL的大试管A中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min。
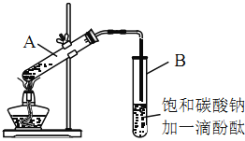
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | ―― | 338.0 | 1.84 |
请回答下列问题:
(1)配制该混合溶液时,加入这三种物质的先后顺序是___________;写出制取乙酸乙酯的化学方程式:___________。
(2)该实验中,浓硫酸的作用是___________。
(3)上述实验中饱和碳酸钠溶液的作用是___________(填字母)。
A 吸收部分乙醇
B 中和乙酸
C 降低乙酸乙酯的溶解度,有利于分层析出
D 加速酯的生成,提高其产率
(4)步骤②中需要小火均匀加热操作,其主要理由是___________。
(5)步骤③中B试管内的上层物质是___________(填物质名称)。
(6)步骤④中分离操作用到的主要仪器是___________;可选用的干燥剂为___________(填字母)。
A 生石灰 B NaOH固体
C 碱石灰 D 无水Na2SO4