��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ�飨ͼ��a��b��c��ʾֹˮ�У��� 
��1���ס�������������������
��2��A��C��E�������װ�ÿ�������ȡCl2 �� д��A�з�����Ӧ�Ļ�ѧ����ʽ �� ��Cl2ͨ�뺬�з�̪��NaOH��Һ�е������� �� �÷�Ӧ�����ӷ���ʽΪ ��
��3��B��D��Eװ����������B��ʢװŨ�����ͭƬ��ͭƬ�����п����ϰ��ϣ������Ƶ�NO2�������й�ʵ�飮 ��д���÷�Ӧ�����ӷ���ʽ ��
������Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ�� �� �ٴ�ֹˮ�� �� ʹ�ձ��е�ˮ�����Թܶ��У�
���Թܶ��е�NO2��ˮ��ַ�Ӧ�������Թ��ڻ���ͨ��һ������O2 �� ֱ���Թ�ȫ������ˮ����������Һ�����ʵ����ʵ���Ũ����molL��1������2λ��Ч��ֵ�����尴��״�����㣩��
���𰸡�
��1����Һ©����Բ����ƿ
��2��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O����Һ��ɫ��ȥ��Cl2+2OH���TCl��+ClO��+H2O
MnCl2+Cl2��+2H2O����Һ��ɫ��ȥ��Cl2+2OH���TCl��+ClO��+H2O
��3��Cu+2NO3��+4H+�TCu2++2NO2��+2H2O��a��b��c��0.045
���������⣺��1������ͼʾ�����Ĺ����ص��жϣ��ס����������������Ƿ�Һ©����Բ����ƿ���ʴ�Ϊ����Һ©����Բ����ƿ����2��A��C��E�������װ�ÿ�������ȡCl2 �� A�ж���������Ũ���Ṳ�����ɶ��Ȼ��̡�������ˮ����Ӧ�Ļ�ѧ����ʽΪ4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O����Cl2ͨ�뺬�з�̪��NaOH��Һ�з������ӷ�ӦΪCl2+2OH���TCl��+ClO��+H2O����Һ��ɫ��ȥ�� �ʴ�Ϊ��4HCl��Ũ��+MnO2
MnCl2+Cl2��+2H2O����Cl2ͨ�뺬�з�̪��NaOH��Һ�з������ӷ�ӦΪCl2+2OH���TCl��+ClO��+H2O����Һ��ɫ��ȥ�� �ʴ�Ϊ��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O����Һ��ɫ��ȥ��Cl2+2OH���TCl��+ClO��+H2O����3����ͭ��Ũ���ᷴӦ��������ͭ������������ˮ���÷�Ӧ�����ӷ���ʽΪCu+2NO3��+4H+�TCu2++2NO2��+2H2O���ʴ�Ϊ��Cu+2NO3��+4H+�TCu2++2NO2��+2H2O��������Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��a��b���ٴ�ֹˮ��c��ʹ�ձ��е�ˮ�����Թܶ��У��ʴ�Ϊ��a��b�� c�����Թܶ��е�NO2��ˮ��ַ�Ӧ�������Թ��ڻ���ͨ��һ������O2 �� ֱ���Թ�ȫ������ˮ��ֱ���Թ�ȫ������ˮ��������Ӧ��4NO2+O2+2H2O�T4HNO3 �� �����Թ������V��������Һ���Ҳ��V�������������Ҳ��V�������ɹ�ʽ�ã�n��NO2��=n��HNO3��=
MnCl2+Cl2��+2H2O����Һ��ɫ��ȥ��Cl2+2OH���TCl��+ClO��+H2O����3����ͭ��Ũ���ᷴӦ��������ͭ������������ˮ���÷�Ӧ�����ӷ���ʽΪCu+2NO3��+4H+�TCu2++2NO2��+2H2O���ʴ�Ϊ��Cu+2NO3��+4H+�TCu2++2NO2��+2H2O��������Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��a��b���ٴ�ֹˮ��c��ʹ�ձ��е�ˮ�����Թܶ��У��ʴ�Ϊ��a��b�� c�����Թܶ��е�NO2��ˮ��ַ�Ӧ�������Թ��ڻ���ͨ��һ������O2 �� ֱ���Թ�ȫ������ˮ��ֱ���Թ�ȫ������ˮ��������Ӧ��4NO2+O2+2H2O�T4HNO3 �� �����Թ������V��������Һ���Ҳ��V�������������Ҳ��V�������ɹ�ʽ�ã�n��NO2��=n��HNO3��= ![]() mol��c��HNO3��=
mol��c��HNO3��= ![]() =0.045mol/L���ʴ�Ϊ��0.045��
=0.045mol/L���ʴ�Ϊ��0.045��
��1����ͼ��֪���������ƣ���2��A��C��E�������װ�ÿ�������ȡCl2 �� A��Ũ������������̷�Ӧ����������������NaOH��Ӧ����NaCl��NaClO�����Խ��ͣ���3��B��D��Eװ����������B��ʢװŨ�����ͭƬ��B��Cu��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����������֤NO2��ˮ�ķ�Ӧ���ر�ֹˮ��a��b���ٴ�ֹˮ��c��ʹ�ձ��е�ˮ�����Թܶ��м��ɣ����е�NO2��ˮ��ַ�Ӧ�������Թ��ڻ���ͨ��һ������O2 �� ֱ���Թ�ȫ������ˮ�����4NO2+O2+2H2O�T4HNO3��c= ![]() ���㣮
���㣮

����Ŀ��I����֪����ӦaA(g)��bB(g)��![]() ��cC(g)��ij�¶��£��� 2 L ���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
��cC(g)��ij�¶��£��� 2 L ���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
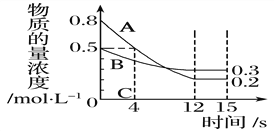
��1�����ⶨǰ4 s��v(C)��0.05 mol��L��1��s��1����÷�Ӧ�Ļ�ѧ����ʽΪ_______________________��
��2����������Ӧ�ֱ��ڼס��ҡ���������ͬ���ܱ������н��У���ͬһ��ʱ�������������еķ�Ӧ���ʷֱ�Ϊ�ף�v(A)��0.3 mol��L��1��s��1�� �ң�v(B)��0.12 mol��L��1��s��1�� ����v(C)��9.6 mol��L��1��min��1����ס��ҡ������������з�Ӧ�����ɿ쵽����˳��Ϊ__________________���üס��ҡ�����ʾ����
��: ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų�������(����������ۺϳɱ�״��)��ʵ���¼���(�ۼ�ֵ)��
ʱ��/min | 1 | 2 | 3 | 4 | 5 | 6 |
�������/mL | 50 | 120 | 224 | 392 | 472 | 502 |
��3����һʱ��η�Ӧ�������__(��0��1��1��2��2��3��3��4��4��5��5��6 min����ͬ)��ԭ����_______________________________________________________
��4�������Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ����������������������зֱ����������������Һ������Ϊ���е���__________(����ĸ)
A.CH3COONa ������B.NaNO3��Һ����������C.KCl��Һ ������ D.Na2CO3��Һ
��5������˵������֤��H2(g)��I2(g)![]() 2HI(g)�Ѵ�ƽ��״̬����______________________
2HI(g)�Ѵ�ƽ��״̬����______________________
A����λʱ��������n mol H2��ͬʱ������n mol HI
B��һ��H��H�����ѵ�ͬʱ������H��I������
C���¶Ⱥ����һ��ʱ�����������ɫ���ٱ仯
D����Ӧ����v(H2)��v(I2)��![]() v(HI)
v(HI)
E���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
F���¶Ⱥ����һ��ʱ�����������ܶȲ��ٱ仯
����Ŀ����֪�������������Ũ���ᷴӦ�ų��������ְ���ͼ��������������ʵ�飮��������װ�зֱ���в�ͬ��Һ�İ�ɫ����Ӧһ��ʱ���ͼ��ָ����λ��ɫ������ȷ���ǣ� ��
�� | �� | �� | �� | |
A | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
B | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
C | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
D | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
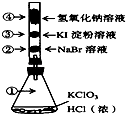
A.A
B.B
C.C
D.D
