题目内容
某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。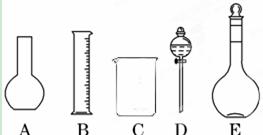
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为: mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(1)AD 玻璃棒、胶头滴管
(2)①③⑥
(3)BDAFEC
(4)13.6mL
(5)将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌
(6)DFG
解析试题分析:(1)配制溶液时用不到平底烧瓶和烧杯,还需要玻璃棒搅拌和引流,胶头滴管定容。(2)容量瓶上标有温度,容积和刻度线。(3)配制的正确顺序是:取溶质-溶解冷却-洗涤-定容-摇匀。(4)利用稀释公式C1V1=C2V2,带入可得。(5)稀释浓硫酸时应防止大量放热,将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌(6)D操作溶质减少,所配浓度减少。F操作溶质减少,所配浓度减少。G操作溶液体积变大,所配溶液浓度减少。
考点:溶液浓度的配制时的正确操作和计算。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案下列是纯净物的是:( )
| A.铝热剂 | B.酒精 | C.植物油 | D.淀粉 |
下列化合物中,不属于有机物的是
| A.甲烷 | B.淀粉 | C.二氧化碳 | D.蔗糖 |
书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是
| A.多糖、石墨、蛋白质、无机盐 |
| B.塑料、石墨、多糖、无机盐 |
| C.蛋白质、炭黑、多糖、无机盐 |
| D.蛋白质、煤炭、多糖、有机玻璃 |
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如图所示
下列有关叙述不合理的是 ( )
| A.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当 |
| B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病 |
| C.在反应①中环丙胺的作用可能是促进氯化铁水解 |
| D.反应②的化学方程式是6FeOOH +CO |
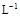 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·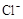 +5Fe3+ +2H2O
+5Fe3+ +2H2O 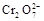 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O B.
B. C.
C. D.
D.
